
УП- Биоорганическая химия
.pdfкурса мы будем использовать положения, изложенные в теории Брѐнстеда-Лоури.
Согласно этой теории кислота – это вещество, которое в процессе реакции является донором протона Н+ (т.е. отдает катион водорода), а основание – вещество, которое в процессе реакции является акцептором протона (т.е. присоединяет катион водорода).
Важно при этом отметить следующее:
1Кислотами и основаниями могут быть как нейтральные, так и заряженные молекулы и частицы.
2Некоторые соединения в разных реакциях могут выступать либо в роли кислоты,
либо в роли основания.
3 Свойство быть кислотой либо основанием вещество проявляет только в реакции с другим соединением.
Рассмотрите внимательно примеры, приведенные на Рис. 7, и найдите среди них подтверждения этих положений.
Внашем курсе мы будем рассматривать кислотно-оснóвные реакции, протекающие
вводных растворах, однако они могут протекать и в газовой фазе (например,
взаимодействие паров HCl и NH3) и на границе твердой фазы и жидкости (например,
твердый СаСО3 и раствор HCl). Вода проявляет амфотерные свойства и может выступать как основанием, так и кислотой. В чистой воде наблюдается слабая автодиссоциация ее молекул (Рис. 7, пример 5). При этом концентрация ионов Н3О+ составляет всего 10-7 М,
как вы знаете из курса неорганической химии. Вода является важнейшим участником всех биохимических взаимодействий и определяет структуру, функциональную активность и взаимодействия всех биологически активных молекул – белков, нуклеиновых кислот,
углеводов, которые находясь в водном окружении, проявляют себя либо как кислоты,
либо как основания.
Таким образом, реакции кислотно-оснóвного взаимодействия имеют важное значение в функционировании живых систем, которое далее мы постараемся проследить.
Простые эфиры – это соединения общей формулы R1-O-R2. Как вы помните из курса органической химии, эти соединения можно получить из спиртов при нагревании в присутствии кислот (диэтиловый эфир часто называют серным, поскольку его получают реакцией этилового спирта с серной кислотой).
Карбонильные соединения имеют общую формулу R1R2C=O, где R1 и R2 –
углеводородные остатки в случае кетонов. В случае, когда R1 или R2 является атомом водорода, соединение называется альдегидом.
11

Карбоксильные соединения имеют общую формулу R-COОН, их также называют
карбоновыми кислотами. Они существенно слабее минеральных кислот, однако более
сильные кислоты, чем спирты и вода.
При взаимодействии карбоновых кислот со спиртами происходит реакция
этерификации с образованием сложных эфиров, общей формулы R1COOR2 (Рис. 6).
Рис. 7. Примеры кислотно-оснóвных взаимодействий молекул. Соединение проявляет свойства кислоты или основания в зависимости от партнера, с которым он вступает в реакцию. Такие пары веществ называют сопряженными кислотами или основаниями.
Соединения, содержащие в своем составе помимо углерода и водорода атом азота –
амины, имеют общую формулу R-NH2 (Рис. 8). На внешней электронной оболочке атома азота находятся 5 электронов – 2s22p3. Три р-электронa образуют ковалентные связи, а
оставшаяся пара электронов предоставляется молекулам-акцепторам, например, протону
(Н+), с образованием катиона R-NH3+. Связь, организованная таким образом (когда атом-
донор предоставляет целую пару электронов, а атом-акцептор – свою свободную
12

орбиталь), называется донорно-акцепторной. Таким образом, в соответствии с теорией Брѐнстеда-Лоури амины являются основаниями, поскольку атом азота в них присоединяет протон, другими словами, является акцептором протона (см. определение
«кислота» и «основание»).
Рис. 8. Амины и амиды. Электроны внешней оболочки азота в этих соединениях.
При взаимодействии карбоновых кислот с аммиаком получаются соединения,
которые называются амиды карбоновых кислот, с общей формулой R-CONH2. В амидах свободная пара электронов у азота находится в сопряжении с π-электронами карбонильной группы и, как следствие, атом азота теряет свою оснóвность.
Соединения, содержащие в своем составе помимо углерода и водорода атом серы –
тиосоединения (меркаптаны) имеют общую формулу R-SH. Их свойства сильно напоминают свойства спиртов и поэтому их часто называют тиолами. Тиолы являются более сильными кислотами (т.е. легче отдают протон основанию), чем аналогичные спирты.
В рамках курса органической химии свойства всех этих соединений вы изучали порознь. Большие биологически активные молекулы, составляющие химическую основу жизни, как правило, содержат несколько функциональных групп в разном сочетании.
Например, в состав аминокислот входят карбоксильные, амино-, амидо-, спиртовые и тиогруппы. В состав углеводов – карбонильные и спиртовые, в состав нуклеиновых кислот – углеводные компоненты, ароматические гетероциклические соединения, а также остатки фосфорной кислоты. Это сочетание различных функциональных групп в составе
13
биомолекул обеспечивает огромный спектр их уникальных химических и биологических свойств. В рамках нашего курса мы постараемся проследить связь структурных особенностей молекул с биологической функцией, которую они выполняют.
14
ЧАСТЬ 1. БЕЛКИ: СТРОЕНИЕ, СВОЙСТВА, ФУНКЦИИ
Белки – это важнейшие биополимеры, выполняющие огромное количество разнообразных функций в организме. В качестве отдельного класса биомолекул белки были обозначены в XVII в результате работ французского химика Антуана де Фуркруа и других ученых. К концу XIX в. стало понятно, что белки представляют собой полимеры,
состоящие из аминокислот, часть из которых была выделена и охарактеризована. В начале
XX в. Эмиль Фишер показал, что аминокислоты в белках соединены пептидными связями.
Одновременно с изучением свойств белков бурно развивались методы их выделения и очистки, что позволило к середине XX в. получать белки в кристаллическом виде и перейти к определению их пространственной (3D) структуры методом рентгеноструктурного анализа, а к концу XX в. – с помощью ЯМР-спектроскопии. В
настоящее время международный банк данных 3D структур белков (Protein Data Bank, PDB) содержит более 100000 природных и модифицированных структур, а также последовательностей ДНК, которые кодируют эти белки. Информация о пространственной организации белка представляет не только теоретический, но и практический интерес, поскольку структура белка определяет свойства и функции,
которые он выполняет в организме. Соответственно, нарушения структуры могут привести к потере функциональной активности белка и, как следствие, заболеванию организма.
Основополагающая роль белков для существования живой материи отражена в высказывании Ф. Энгельса: «Жизнь есть способ существования белковых тел,
существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь,
что приводит к разложению белка».
1.1Аминокислоты
1.1.1Строение, номенклатура, свойства
Аминокислоты – это молекулы, из которых, как из строительных блоков, состоят белки, и комбинация свойств которых фактически определяет свойства белков.
Аминокислотами называют любые органические соединения, в состав молекул которых входят аминогруппа и карбоксильная группа. На Рис. 1.1, приведены структуры некоторых аминокислот, можно видеть, насколько разнообразными они бывают.
15

Приведенное определение является слишком широким, охватывая чрезвычайно большой круг соединений. Аминокислоты можно разделить на два больших класса – алифатические и ароматические, но и такая классификация будет слишком
Рис. 1.1. Структуры некоторых аминокислот.
неопределенной. В основу классификации аминокислот, встречающихся в живой природе,
положено взаимное расположение амино- и карбоксильной групп. Согласно такой классификации различают α-, ß-, γ-, δ-, ε- и т.д. аминокислоты (см. примеры на Рис. 1.1).
Особое место среди них занимают α-аминокислоты, в которых амино- и
карбоксильная группы находятся при одном и том же атоме углерода: 20 аминокислот этого ряда входят в состав белков. Состав, количество и последовательность этих аминокислот определяют свойства громадного разнообразия белковых молекул.
Генетический аппарат всех известных живых форм на Земле кодирует и наследует последовательность именно этих аминокислот в белках.
В рамках данного курса основное внимание будет уделено изучению именно этих α-
аминокислот. Их структура представлена в Таблице 1.1. Нетрудно видеть, что они различаются строением бокового радикала R. Конечно, каждая из этих аминокислот имеет номенклатурное название (например, аминоэтановая кислота – глицин). Однако, как правило, используют исторически сложившиеся тривиальные названия, связанные с
16

Таблица 1.1
17

открытием этих аминокислот или источником, из которого они впервые выделены. В
тексте принято указывать аминокислоты латинскими буквами в трехбуквенном, либо однобуквенном обозначении, которые также приведены в Таблице 1.1. В ранней русской литературе можно встретить трехбуквенное обозначение на русском языке.
По структуре и свойствам бокового радикала все аминокислоты можно разделить на
3 группы – 9 аминокислот с гидрофобным боковым радикалом, 6 аминокислот с полярным, но незаряженным боковым радикалом и 5 – с заряженным боковым радикалом.
Самая маленькая аминокислота – глицин (Gly, G), в качестве бокового радикала имеет атом водорода. Благодаря отсутствию громоздкого бокового радикала вращение
18
вокруг ковалентных связей α-углеродного атома свободное, и часто эта аминокислота встречаеся в участках белка, где требуется их высокая подвижность.
Аланин (Ala, A), валин (Val, V), лейцин (Leu, L) и изолейцин (Ile, I) в качестве боковых радикалов содержат алифатические радикалы разной длины и строения.
Соответственно, в этом ряду с увеличением бокового радикала подвижность молекулы белка в участках с этими аминокислотами уменьшается. Кроме того, участки белка,
богатые этими аминокислотными остатками, обладают высокой гидрофобностью.
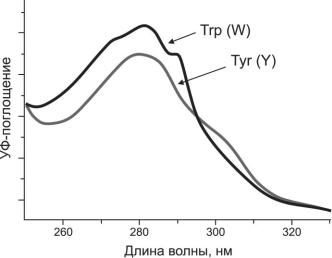
Метионин (Met, M) содержит в своем составе атом серы. Интересно, что синтез всех белков на рибосоме стартует с триплета AUG, который кодирует эту аминокислоту и является для нее единственным. В этой же группе находятся аминокислоты с ароматическим боковым радикалом – фенилаланин (Phe, F) и триптофан (Trp, W). Эти аминокислоты также формируют гидрофобные участки белка. Характерным свойством этих ароматических аминокислот, а также тирозина (Tyr, Y), является способность поглощать ультрафиолетовый (УФ) свет (Рис. 1.2). Характерная полоса поглощения триптофана и тирозина с максимумом при длине волны λ=280 нм используется при работе с белками для их идентификации, определения количества, при хроматографической очистке и т.д. Вклад фенилаланина в поглощение белков на этой длине волны существенно меньше.
Рис. 1.2. УФ-спектры поглощения триптофана и тирозина. Эти амиокислоты вносят основной вклад в поглощение белков при длине волны λ=280 нм.
Во второй группе находятся аминокислоты с гидроксильной группой в боковом радикале – серин (Ser, S) и треонин (Thr, T), а также с сульфгидрильной (или тио) группой
19
– цистеин (Cys, C). Функциональные группы этих радикалов поляризованы (на кислороде и сере находится частичный отрицательный заряд) и в водных растворах способны образовывать водородные связи. Особым свойством цистеина является способность окисляться с образованием дисульфидных мостиков (S-S), которые являются важнейшими структурными элементами белков. К этой же группе аминокислот относят аспарагин (Asn, N) и глутамин (Gln, Q), в боковых радикалах которых находятся высокополяризованные амидные группы. Эти две аминокислоты являются амидными производными двух других аминокислот – аспарагиновой (Asp, D) и глутаминовой (Glu, E) кислот, входящих в третью группу и имеющих заряженный боковой радикал – остаток карбоновой кислоты.
(Вопрос: как они диссоциируют?). Таким образом, Asp и Glu, имеющие в своем боковом радикале дополнительную карбоксильную группу, являются моноаминодикарбоновыми кислотами. Поскольку при физиологических значениях рН эти группы диссоциированы,
иногда эти аминокислоты называют «аспартат» и «глутамат».
В третью группу также входят лизин, аргинин и гистидин.
Лизин (Lys, K) – аминокислота с дополнительной аминогруппой в боковом радикале, протонированной при физиологических значениях рН, т.е. эта молекула имеет дополнительный заряд +1.
Аргинин (Arg, R) имеет в боковом радикале гуанидиновую группировку, также протонированную, с распределенным положительным зарядом по двум концевым атомам азота.
И, наконец, гистидин (His, H) имеет в своем боковом радикале имидазольный остаток с двумя атомами азота в пятичленном цикле. Один из них отдает свою пару электронов в общую сопряженную цепь для создания ароматической структуры (это энергетически выгодное состояние молекулы), а другой использует эту пару для присоединения протона. В целом, таким образом, остаток гистидина несет положительный заряд. Однако гистидин довольно слабое основание, его протонирование происходит при рН ниже 6, так что в физиологическом диапазоне рН 6-7 гистидин может выступать и как основание, и как кислота, что часто имеет место в кислотно-оснóвных взаимодействиях, протекающих в каталитических центрах многих ферментов.
Пролин (Pro, P) отличается от других аминокислот тем, что в его составе имеется не амино-, а иминогруппа. В этой структуре вращение вокруг связи N-Сα невозможно и, как правило, пролин находится в тех участках белка, где требуется жесткость молекулы или формируется изгиб полипептидной цепи.
20
