

161
Гюнтера синтезируется аномальный изомер уропорфириногена, что сопровождается развитием анемии, фотодерматитов, выделением мочи оранжевого цвета (из-за большого количества порфиринов в ней), появлением коричневого оттенка эмали зубов.
11.2.2. Переваривание и распад гемоглобина в тканях Распад гемоглобина осуществляется в процессе переваривания
гемопротеидов в желудочно–кишечном тракте и в тканях при распаде эритроцитов.
Вжелудке в процессе переваривания под действием пепсина отщепляется глобин, к гему присоединяется HCl с образованием солянокислого гематина коричневого цвета. Поэтому при желудочных кровотечениях содержимое желудка приобретает шоколадный оттенок. В кишечнике отщепляется соляная кислота, и постепенно формируются пигменты дегтярно-черного цвета. Поэтому при кишечных кровотечениях стул имеет чёрный цвет.
Распад гемоглобина в тканях происходит при распаде эритроцитов (у взрослых через 120 дней, у детей около 80 дней) в лимфоидных клетках, костном мозге, селезёнке, печени. Освободившийся гемоглобин при распаде эритроцитов соединяется с белком гаптоглобином и транспортируется в клетки РЭС (ретикуло-эндотелиальная - система), где происходит распад гемоглобина.
На первом этапе под действием гемоксигеназы происходит разрыв одного метинового мостика. Тетрапиррольная структура гемоглобина разворачивается
иобразуется вердоглобин. Вердоглобин расщепляется на глобин, железо и биливердин (пигмент зелёного цвета). Затем биливердин восстанавливается в билирубин (оранжево-желтый пигмент). Билирубин плохо растворим в воде и очень токсичен. Для транспорта гидрофобного билирубина в печень происходит его адсорбция на белках плазмы крови, вследствие чего повышается гидрофильность билирубина. Данная форма билирубина называется свободный билирубин (неконъюгированный),так как химически он с белками не связан или непрямой билирубин, так как он даёт цветную реакцию не сразу, а после осаждения белков.
Непрямой билирубин поступает в печень, захватывается гепатоцитами и обезвреживается путём присоединения к нему глюкуроновой кислоты с образованием сначала моноглюкуронида, а затем диглюкуронида билирубина. Эта форма билирубина также имеет 2 названия: связанный билирубин, так как он химически связан с глюкуроновой кислотой или прямой билирубин,так как сразу даёт качественную цветную реакцию. Далее прямой билирубин с затратой энергии АТФ экскретируется в жёлчь, и в составе жёлчи поступает в тонкий кишечник.
Вкишечнике под действием микрофлоры отщепляется глюкуроновая кислота и образуется новый пигмент мезобилиноген (уробилиноген). Часть его по vena porta поступает в печень, где в норме он разрушается до дипирролов и трипирролов и выводится с жёлчью. Другая часть мезобилиногена в кишечнике переходит в стеркобилиноген. Основная часть стеркобилиногена (около 300 мг) выводится через кишечник в виде стеркобилиногена (коричневый пигмент). Другая часть его по системе геморроидальных вен попадает в кровь и

162
выводится через почки в составе мочи (около 4 мг).
Схема распада гемоглобина в тканях
11.2.3. Нарушения распада гемоглобина Концентрация билирубина в крови не высока, составляет 2(8)-20 мкмоль/л
Повышение уровня билирубина в крови - гипербилирубинемия клинически проявляется в виде желтухи. Непрямой билирубин нейротоксичен. Прямой билирубин водорастворим и может выводиться с мочой.
По месту нарушения пигментного обмена различают
гемолитические желтухи (надпечёночные), паренхиматозные (печёночные),
механические (подпечёночные).
По характеру повышения фракций билирубина выделяют:
конъюгированные, неконъюгированные, смешанные желтухи.
Неконъюгированные (гемолитические) желтухи развиваются при усиленном гемолизе эритроцитов. В крови отмечается повышенное содержание непрямого билирубина. Содержимое кишечника пигментировано, поскольку в печени повышено образование стеркобилиногена. В моче также повышено содержание стертобилина и уробилина, она имеет тёмный цвет. Разновидностью неконьюгированных желтух является болезнь Жильберта,при

163
которой снижено поступление и захват билирубина гепатоцитами.
Смешанные (паренхиматозные) желтухи развиваются при поражении печени. При данном виде желтухи в крови повышен и непрямой билирубин, так как печень не может его обезвредить, и прямой билирубин, так как затруднено его выведение в жёлчь. Моча пигментирована, в ней присутствуют билирубин и уробилин. Содержимое кишечника более светлое, так как снижено образование и выведение стеркобилина. Разновидностью смешанной желтухи является желтуха Криглера-Найяра,при которой в печени снижена активность фермента глюкурнилтрансферазы.
Механические (конъюгированные) желтухи развиваются при нарушениях оттока жёлчи (опухоль, камень). В крови на первых этапах заболевания повышено содержание прямого билирубина. Моча пигментирована за счёт присутствия билирубина, а содержимое кишечника светлое (ахоличное). Разновидностью коньюгированной желтухи является желтуха Дубина – Джонсона, при которой затруднено выведение прямого билирубина в жёлчь.
При желтухе новорожденных концентрация билирубина может повышаться до 40 мкмоль/литр и выше. Причинами неонатальной желтухи являются усиленный гемолиз эритроцитов, сниженный захват билирубина гепатоцитами, снижение активности глюкуранилтрансферазы, снижение экскреции прямого билирубина в жёлчь, стерильность кишечника.
11.3. Химический состав плазмы крови
11.3.1. Белки плазмы крови Белки являются основными компонентами плазмы крови.
Общее содержание белков плазмы крови у взрослых составляет 60-80 г/л. Концентрация белков в плазме крови у новорожденных равняется 56 г/л, повышаясь у годовалых детей до 65 г/л.
Белки плазмы крови выполняют ряд важных функций:
∙определяют физико-химические константы крови (вязкость, рН, онкотическое давление);
∙транспортная функция – перенос водонерастворимых веществ, ионов металлов;
∙защитная функция – входят в состав антител;
∙участвуют в свёртывании крови – гемокоагуляция;

164
∙регуляторная функция – в плазме присутствуют белковые гормоны, ферменты;
∙представляют резерв аминокислот и связанных с ними металлов;
Методом высаливания белки плазмы крови делятся на 3 фракции: альбумины - 30-50 г/л, глобулины- 20-30 г/л, фибриноген - 2-4 г/л.
Методом электрофореза на бумаге все белки плазмы крови делятся на 5 фракций: альбумины и α1, α2, β, γ – глобулины.
На альбумины приходится 60% всех белков плазмы крови. Альбумины имеют молекулярную массу меньше 100 тысяч д., богаты полярными гидрофильными аминокислотами, электрофоретически подвижны. Альбумины растворяются в дистиллированной воде, высаливаются 100% раствором (NH4)2SO4. Альбумины, синтезируются в печени, выполняют транспортную функцию, определяют физико-химические свойства крови.
Глобулины составляют 40% всех белков плазмы крови. Глобулины – гетерогенная фракция белков. Содержание α1-глобулинов равняется 4%, α2 - глобулинов - 8%, β- глобулинов -12%, γ- глобулинов - 16%. Молекулярная масса глобулинов около 200 тысяч д. Они менее гидрофильны, растворяются в 10% растворах солей, осаждаются 50% (NH4)2SO4. Глобулины синтезируется в печени, лимфоцитах, макрофагах. К основным функциям глобулинов относятся транспортная, защитная функции.
Всоставе глобулиновой фракции выделяют отдельные белки.
∙Белки α1 -глобулиновой фракции Протромбин - белок свёртывающей системы крови;
α1-гликопротеид – переносит некоторые стероидные гормоны; α1 – антитрипсин – ингибитор трипсина;
Орозомукоид – гликопротеид, ингибитор протеаз, обладает
иммуномодуляторным действием.
∙Белки α2-фракции глобулинов Гаптоглобин – переносит гемоглобин;
α2- макроглобулин – обладает антипротеазной активностью, является ингибитором свёртывающей и фибринолитической системы крови, ингибитор синтеза кининов;
С-реактивный белок даёт реакцию преципитации с пневмококком, обладает антипротеазной активностью;
Церулоплазмин – переносит медь, обладает ферментативной оксидазной активностью.
∙Белки β -фракции глобулинов С реактивный белок – белок, участвующий в воспалительной реакции;
Трансферрин – переносит железо, входит в антиоксидантную систему
крови; Гемопексин – переносит гемм, порфирины, гемоглобин;
Фибриноген – фактор свёртываемости крови.
Белки γ- фракции глобулинов представлены антителами или иммуноглобулинами (Ig) 3-х основных видов: G,А,М и 2-х минорных: Д,Е.
Все иммуноглобулины имеют вилкообразную структуру. В их составе представлены две тяжелых Н цепи (500-60

165
аминокислот) и две легких L цепи (до 200 аминокислот), цепи соединяются дисульфидными связями. Вторичная структура Н и L цепей имеет β - складчатую укладку, цепи параллельны, в их составе выделяют доменные участки. В составе цепей есть постоянные участки и вариабельные участки, за счёт которых и происходит взаимодействие Ig с большим количеством антигенов. В IgА содержатся 3 «вилки», в IgМ – 5 «вилок».
У новорожденных представлены все виды иммуноглобулинов, но содержание их ниже, чем у взрослых людей. В этот период основным является IgG, который проходит плацентарный барьер и попадает в плод из организма матери. К возрасту одного года содержание IgG становится равным его содержанию у взрослых, к двум годам концентрация IgА достигает уровня взрослых людей.
В плазме крови в небольшой концентрации присутствуют белки интерфероны (ИФ) различных видов:
α – (ИФА) синтезируются в лимфоцитах и макрофагах β – (ИФБ) синтезируются в фибробластах
γ – (ИФГ) синтезируются в различных тканях и в Т-лимфоцитах Интерфероны обладают антипролиферативным действием, стимулируют
дифференцировку клеток, оказывают противоопухолевое действие, активируют иммунные процессы. Концентрация интерферонов возрастает при вирусных заболеваниях. Интерфероны обладают антивирусной активностью, которая связана с активацией иммунитета, угнетением РНК - полимеразы, активацией РНК - азы.
Ферменты плазмы крови делятся на 3 группы.
Секреторные ферменты синтезируются в печени и секретируются в кровь. Их примерами являются холинэстераза, факторы свёртывания крови. В норме активность ферментов данной группы выше, чем при заболеваниях.
Экскреторные ферменты синтезируются в печени, экскретируются в жёлчь (щелочная фосфатаза). При заболеваниях активность экскреторных ферментов увеличивается.
Индикаторные ферменты в норме практически отсутствует в плазме крови, при заболеваниях их активность возрастает.
11.3.1.1. Изменение белкового состава крови при заболеваниях Гипопротеинемия - снижение общего содержания белков в плазме крови.
Она может встречаться при белковом голодании, заболеваниях желудочно–кишечного тракта, печени, почек.
Диспротеинемия - изменение соотношения отдельных фракций белков (в норме альбумин-глобулиновый коэффициент равен 1,5:1,9). В острой стадии воспалительных заболеваний в плазме увеличивается содержание глобулинов α и β фракций. К белкам острой стадии воспаления относятся, в частности, гаптоглобин, орозомукоид, с– реактивный белок. Считается, что белки острой фазы воспаления оказывают защитное действие на ткани, угнетают агрессивные протеолитические ферменты тканей. При хронических заболеваниях в плазме увеличивается содержание иммуноглобулинов.
Парапротеинемия - появление в плазме патологических белков, таких как

166
криоглобулины (осаждаются при температуре ниже 37 о), пироглобулинов (осаждается при 60-80о С), фетопротеин (эмбриональный белок).
11.3.2. Небелковые азотсодержащие вещества крови Сумма низкомолекулярных азотистых веществ, остающихся в крови после
осаждения белков, называется остаточным азотом (RN). В норме он составляет 15-25 ммоль/л. 50% остаточного азота составляет мочевина, концентрация которой равняется 3,3-8 ммоль/л, 25% остаточного азота приходится на аминокислоты. В состав остаточного азота крови входят также пептиды,
мочевая кислота (0,2-0,4 ммоль/л), аммиак (20-80 мкмоль/л), билирубин (2-8,20
мкмоль/л), креатинин (60-130 мкмоль/л).
Большинство компонентов остаточного азота являются конечными продуктами азотистого обмена, которые выводятся через почки. В связи с этим при патологии почек содержание RN резко увеличивается, развивается симптом ретенционной азотемии. Продукционная азотемия встречается при увеличенном распаде белков, онкологических заболеваниях.
11.3.2.1. Кининовая система крови.
Кинины представлены пептидом брадикинином (9 аминокислотных остатков), каллидином (10 остатков аминокислот) и
лизил-метионил-брадикинином (содержит 11 аминокислот).
Биологическое действие кининов моногообразно. Они регулируют гемодинамику, увеличивают работу сердца, расширяют сосуды, вызывают спазм гладкой мускулатуры бронхов, матки, являются медиаторами воспаления, участвуют в регуляции свёртывающей и антисвёртывающей системы крови, обладают
иммуномодуляторным действием.
Кинины синтезируются из неактивных белков предшественников - кининогенов. В синтезе кининов участвуют протеолитические ферменты каликренины. Калликренины, в свою очередь, образуются из не активных
каликрииногенов (прекалликреиногенов), при участии трипсина, плазмина крови. Распад кининов до аминокислот осуществляется ферментами кининаазами.
11.3.3. Безазотистые органические вещества крови К безазотистым органическим веществам крови относятся углеводы и
липиды. Глюкоза содержится в крови в концентрации 3,3-5,5 ммоль/л. В крови присутствуют различные метаболиты углеводного обмена (пируват, лактат, и другие). Содержание сиаловых кислот составляет 2,2-2,6 ммоль/л. Общее содержание липидов у взрослых людей находится в интервале 4-8 г/л. Концентрация триацилглицеринов составляет 1,5-2,5 ммоль/л, фосфолипидов - 2,5-3,5 ммоль/л, холестерина - 3,5-5,2 ммоль/л, свободных жирных кислот - 0,4-0,8 ммоль/л. У детей содержание всех видов жиров, кроме свободных жирных

167
кислот, ниже, чем у взрослых.
11.3.4. Минеральные вещества крови Основным минеральными компонентами плазмы крови являются натрий,
концентрация которого составляет(130 ммоль/л) и хлориды (98-107 ммоль/л). Значительно ниже уровень калия (4-5 ммоль/л) и железа (19 мколь/л).
11.4. Физико-химические свойства крови.
Плотность крови равняется 1,050-1,060 г/см3, зависит от суммы растворённых в крови веществ. Плотность крови определяется прибором ареометром.
Вязкость крови равна 5-6 единиц относительно вязкости дистиллированной воды, определяется вискозиметрическим методом (оценивается вязкость по скорости перемещения жидкости).
Осмотическое давление крови составляет 7,8-8,1 атмосферы. Для определения осмотического давления используют криоскопический метод, основанный на сравнении температуры замерзания плазмы крови и воды. Осмотическое давление учитывается при внутривенном введении жидкости. Жидкости с осмотичеким давлением, равным осмотическому давлению крови, называются изотоничными (0,9% NaCl, 5% глюкоза). Их можно вводить в кровь в достаточно большом объёме. Жидкости с более высоким осмотическим давлением – гипертонические растворы (40% глюкоза). Введение этих жидкостей допустимо в небольших объёмах, т.к. они вызывают обратимое сморщивание эритроцитов. Растворы с более низким давлением – гипотонические (дистиллированная вода). Введение гипотонических растворов недопустимо, поскольку они вызывают набухание и разрыв эритроцитов.
рН крови находится в интервале 7,36-7,44. Отклонение рН от физиологических значений инактивирует ферменты, поэтому величина рН поддерживается на постоянном уровне физиологическими регуляторами рН (лёгкие, почки, желудочно–кишечный тракт, потовые железы) и физико-химическими регуляторами (буферные системы крови).
Буферные системы включают акцептор протонов (чаще соль) и донор протонов (чаще кислота). Величина рН, которую создает буферная система, рассчитывается по формуле: рН= рК + lg ([акц]/[дон]). В крови человека присутствует четыре буферные системы:
∙бикарбонатная система, состоящая из Н2СО3/NаНСО3;
∙гемоглобин – оксигемоглобиновая система, состоящая из ННв/ННвО2;
∙белковая система, включающая белок - NН2 / белок - СООН;
∙фосфатная система представлена NаН2РО4/Nа2НРО4.
Буферная емкость крови достаточно высока. Для сдвига рН на 0,1 единицы необходимо добавить 4,5 мл 0,1n NаОН.
Бикарбонатная буферная система представлена Н2СО3, и NаНСО3.. Так как угольная кислота слабая, то оценивается концентрация СО2. Угольная кислота является донором протонов: Н2СО3→Н+ + НСО3- - противодействует защелачиванию. Акцептором протонов является соль: НСО3-- + Н+→ Н2СО3.
рН=рК + lg ([НСО3-]/0,03 [Н2СО3]). В физиологических условиях

168
поддерживается соотношение НСО-3/ Н2СО3= 20/1.
Гемоглобин - оксигемоглобиновая буферная система включает ННв и ННвО2. Донором протонов является ННвО2 . В лёгких происходит уменьшение концентрации угольной кислоты, что могло бы сопровождаться защелачиванием. Но ННвО2 диссоциирует на протон Н+ и анион НвО2- и препятствует сдвигу рН. Акцептром протонов является ННв. В тканях увеличивается содержание углекислоты, что могло бы вести к закислению, но происходит связывание протонов по реакции: Н+ + НвО2-→ ННвО2→ ННв + О2 , что противодействует закислению.
В сумме на бикарбонатную и гемоглобин – оксигемоглобиновую системы приходится до 80% буферной ёмкости крови. Обе они функционируют вместе с лёгкими.
Белковая буферная система обусловлена амфотерными свойствами белков. Акцептором протонов являются аминогруппы белков: белок-NН2 + Н+ → белок NН3 + (противодействие закислению). Донором протонов служат карбоксильные группы белков: белок - СООН → СОО - + Н+ (противодействие защелачиванию). На долю белкового буфера приходится до 18% всей буферной емкости крови.
Фосфатная буферная система представлена фосфатами НРО42- /Н2РО4-. Однозамещённый фосфат является акцептором протонов: НРО42— + Н+→ Н2РО4-(противодействие закислению). Донором протонов служит двузамещённый фосфат: Н2РО4-→ НРО42- + Н+ (противодействие защелачиванию).
рН= рК + lg ([НРО42-] / [ Н2РО4-]). Физиологические значение рН система поддерживает при соотношении Nа2НРО4 / NаНРО4 = 4:1. На долю фосфатной буферной системы приходится около 4-5% буферной ёмкости крови. Она функционирует в основном с почками.
11.4.1. Нарушения кислотно-основного баланса Изменения кислотно–основного баланса могут быть двух видов: ацидозы –
закисление среды и алкалозы – защелачивание среды. По степени выраженности ацидозы и алкалозы делят на 3 группы:
∙компенсированные (сдвиг рН = 7,40 ± 0,05);
∙субкомпенсированные (сдвиг рН = 7,40 ± 0,15);
∙декомпенсированные (сдвиг рН = 7,40 ± 0,25).
По механизму развития выделяют следующие виды ацидозов и алкалозов:
∙дыхательные (респираторные);
∙метаболические;
∙смешанные.
Для диагностики различных видов ацидозов и алкалозов применяют аппаратные методы измерения величины рН при разной концентрации СО2 в крови. По специальным графикам-номограммам определяют несколько показателей кислотно-основного состояния.
1.Бикарбонаты крови
а) АВ - истинные (актуальные) бикарбонаты, содержащиеся в данных
условиях;
б) SB - стандартные бикарбонаты), те же бикарбонаты, но рассчитанные на

169
стандартные условия: рСО2 = 40 мм рт. ст., ННвО2 = 100%, t = 380. Содержание SB равно 29-28 ммоль/л.
2.Буферные основания - сумма всех буферных компонентов: бикарбонаты + белок + гемоглобин + фосфаты.
а) ВВ - реальные буферные основания, содержащиеся в физиологических условиях;
б) NВВ - нормализованные буферные основания, рассчитанные на стандартные условия. Их концентрация равна 32-65 ммоль/л.
3.ВЕ - избыток или дефицит буферных оснований - разница между буферными основаниями (ВЕ = ВВ – NВВ). В норме ВЕ равна ± 2,3 ммоль/л.
ВЕ – важный показатель, позволяющий быстро принять меры для нормализации рН.
Дыхательные ацидозы возникают при задержке СО2 при заболеваниях лёгких (пневмония, пневмосклероз). Развивается сдвиг рН крови в кислую сторону в силу накопления угольной кислоты. Повышение парциального давления СО2 сопровождается увеличением концентрации бикарбонатов и увеличением АВ. Это, в свою очередь, приводит к незначительному возрастанию ВЕ.
Метаболические ацидозы возникают при накоплении в тканях кислых компонентов (молочная кислота, кетоновые тела), при задержке протонов в организме при заболеваниях почек. рН крови смещается в кислую сторону. Использование бикарбонатов для нейтрализации кислот ведёт к уменьшению АВ и, соответственно, к снижению парциального давления рСО2. Уменьшение содержания бикарбонатов сопровождается значительным снижением величины ВЕ.
Респираторные алкалозы наблюдаются при учащении дыхания и уменьшении содержания углекислоты. Реакция крови смещается в щелочную сторону. Дефицит углекислоты сопровождается снижением уровня АВ и, как следствие, уменьшением ВЕ.
Метаболические алкалозы возникают при потере кислот из организма. Например, при потере НСl при рвоте, избыточном выведении протонов через почки (при гиперальдерстеронизме) или при введении в организм щелочных компонентов. Реакция крови смещается в щелочную сторону. Накопление бикарбонатов крови сопровождается повышением концентрации СО2 и значительным избытком ВЕ.
11.4.2. Особенности кислотно-основного состояния у детей.
Уноворожденных выявляется более кислая реакция крови (рН может снижаться до 7,2), что связанно с высокой концентрацией лактата в крови.
Уноворожденных снижено р СО2, т.к. выше частота дыхания.
Удетей имеют место дефицит ВЕ (отрицательные значения ВЕ), т.к. повышено образование лактата и снижена способность почек к выведению протонов.
Удетей первых лет жизни выражена склонность к ацидозу.
11.5.Дыхательная функция крови
170
11.5.1. Транспорт кислорода и его нарушения Перенос кислорода от лёгких к тканям кровью осуществляется в 2 формах:
∙в растворённом состоянии,
∙в виде оксигемоглобина.
Растворенный в плазме кислород составляет около 1,5% от всего переносимого кровью кислорода или 0,03 мл/100 мл крови. Невысокое содержание данной формы кислорода связано с его ограниченной растворимостью в воде. Величина растворённого в крови кислорода может быть увеличена при использовании гипербарической оксигенации.
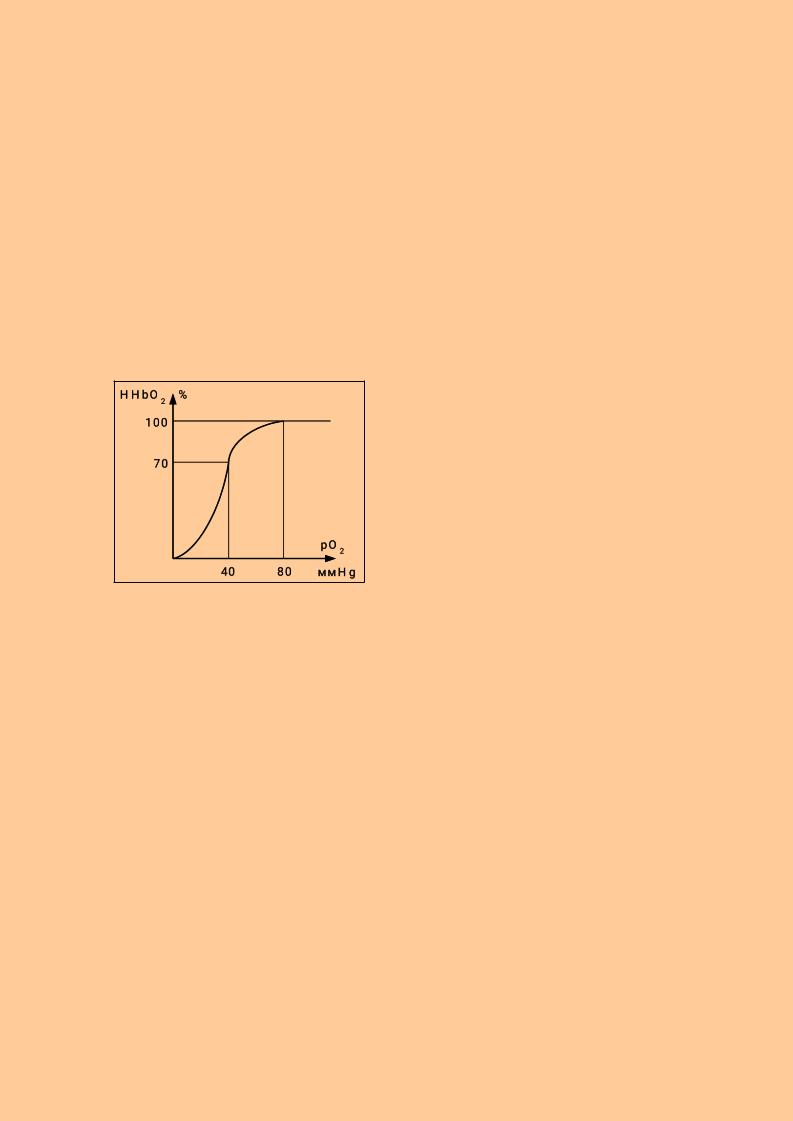
В виде оксигемоглобина переносится основная часть кислорода крови. Связывание кислорода с гемоглобином зависит от целого ряда факторов и, прежде всего, от парциального давления кислорода. В артериальной крови оно равно 80 мм рт. ст., в венозной -30-40 мм рт. ст. Соответственно насыщение гемоглобина кислородом в артериальной крови составляет 100%, в венозной крови
около 70%.
Кривая насыщения гемоглобина кислородом носит S-образный характер. Это обусловлено кооперативными изменениями конформации протомеров в олигомерном гемоглобине. Соединение кислорода с одним протомером резко повышает чувствительность к кислороду других протомеров. Такой характер кривой
обеспечивает способность гемоглобина связывать и отдавать кислород в широком диапазоне его парциального давления. Отдача и поглощение кислорода составляют 30% или 5-6 мл/100 мл крови.
На характер кривой насыщения гемоглобина кислородом влияют:
∙рН (эффект Бора) - закисление сопровождается присоединением протонов к НвО2- и последующей диссоциацией оксигемоглобина: Н*+ НвО2- → ННвО2→ННв+О2→в ткань (закисление облегчает отдачу кислорода в ткани);
∙повышение концентрации угольной кислоты – источника протонов вызывает аналогичные сдвиги;
∙повышение температуры увеличивает диссоциацию оксигемоглобина;
∙повышение концентрации 2,3-дифосфоглицерата - аллостерического регулятора увеличивает отдачу кислорода оксигемоглобином.
Особенности транспорта кислорода у детей связаны с высоким содержанием фетального гемоглобина (НвF), который более прочно удерживает кислород, что отражает особенности внутриутробного дыхания. Фетальный гемоглобин имеет более короткий срок жизни, он легче окисляется и труднее отдаёт кислород.
Нарушения транспорта кислорода сопровождаются развитием гипоксии (дефицит кислорода в тканях). Различают высотную, альвеолярную (заболевания лёгких), циркуляторную (нарушение кровообращения), тканевую
