
4 курс / Дерматовенерология / Папуло_пустулезная_форма_розацеа_у_женщин_Хворик_Д
.pdf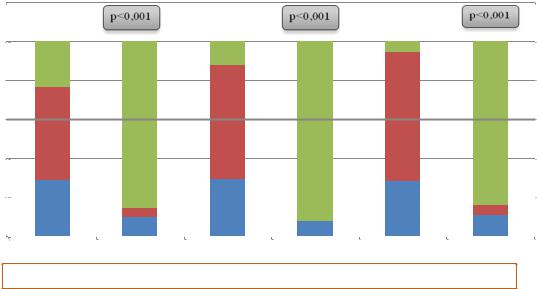
терапию (р<0,001). Кроме того, в 4,2% случаев при проведении традиционного лечения не наблюдалось клинического эффекта (таблица 6.1).
При проведении стандартной терапии у пациентов с тяжелой степенью тяжести ППР клиническая ремиссия достигнута лишь у 5,6% из их числа, что было достоверно ниже по сравнению с группой, пациенты в которой получали комбинированное лечение по оригинальной схеме (73,7%) (р<0,001). Лечение было неэффективным у 5,6% пациентов при использовании традиционной терапии (таблица 6.1). При оценке клинической эффективности ни в одной из групп не отмечено случаев ухудшения состояния пациентов.
Продолжительность ремиссии является ключевым критерием эффективности лечебно-профилактических мероприятий. Для оценки отдаленных результатов лечения учитывалось число впервые возникших обострений за 12 месяцев проспективного наблюдения. Для изучения длительности ремиссии контрольный осмотр проводился у пациентов всех групп через 6 и 12 месяцев после окончания лечения (рисунок 6.1).
|
120 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12,5 |
|
|
5,6 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
23,8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
66,7 |
|
|
|
|
|
|
||||||
% 60 |
|
|
|
47,6 |
85,7 |
58,3 |
92 |
|
|
84,2 |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28,6 |
4,8 |
29,2 |
|
|
27,8 |
|
|
5,3 |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
9,5 |
|
|
|
|
|
|
|
|
|
|
10,5 |
|
|
|
|||
0 |
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
1 А |
|
1 Б |
|
|
|
2 А |
|
2 Б |
|
|
|
3 А |
3 Б |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
рецидив до 12 месяцев |
|
|
|
рецидив до 6 месяцев |
|
|
|
отсутствие рецидивов |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примечания – 1 – А – подгруппа пациентов, получавших стандартную терапию;
2 – Б – подгруппа пациентов, получаших комбинированную терапию;
3 – p – достоверность различий между отсутствием рецидивов в подгруппах А и Б в пределах одной группы
Рисунок 6.1. – Частота развития рецидивов после окончания лечения
~ 81 ~

После проведения комбинированного лечения по оригинальной схеме достигнутый клинический эффект сохранялся в течение года у подавляющего большинства пациентов (от 84,2% с тяжелой и до 92,0% со средней степенью тяжести). Частота развития рецидивов у данных пациентов диагностировалась достоверно реже по сравнению с лицами, получавшими традиционную терапию, и составила при легкой степени тяжести 14,3%, средней – 8,0%, тяжелой – 15,8% (во всех случаях сравнения р<0,001). Использование метода комбинированного лечения, включающего назначение фототерапии, топических средств азелаиновой кислоты и антибиотика по оригинальной схеме в зависимости от степени тяжести ППР, приводило к повышению эффективности лечения ППР и снижению частоты рецидивов при легкой степени тяжести на 61,9%, при средней – на 79,5%, при тяжелой – на 78,6%.
Следующим этапом оценки эффективности лечения было определение достижения элиминации D. folliculorum с кожных покровов при ППР. Через месяц после окончания лечения у пациентов во всех группах, получавших как традиционное, так и комбинированное лечение по оригинальной схеме в зависимости от степени тяжести ППР, наблюдалось снижение инфицированности данным сапрофитом (таблица 6.2).
Таблица 6.2. – Оценка инфицированности D. folliculorum до лечения и через месяц после его завершения у пациентов с ППР
(абс/%)
|
Инфицированность D. folliculorum |
|
||||
Подгруппа |
до лечения |
через месяц после |
р |
|||
пациентов |
окончания лечения |
|||||
|
|
|
||||
|
абс. |
% |
абс. |
% |
|
|
1А (n=21) |
11 |
52,4±10,9 |
4 |
19,1±8,6 |
р<0,05 |
|
|
|
|
|
|
|
|
1Б (n=21) |
11 |
52,4±10,9 |
4 |
19,1±8,6 |
р<0,05 |
|
2А (n=24) |
14 |
58,3±10,1 |
6 |
25,0±8,8 |
р<0,05 |
|
2Б (n=25) |
16 |
64,0±9,6 |
6 |
24,0±8,5 |
р<0,05 |
|
3А (n=18) |
13 |
72,2±10,6 |
7 |
38,9±11,5 |
р>0,05 |
|
3Б (n=19) |
12 |
63,2±11,1 |
4 |
21,1±9,4 |
р<0,05 |
|
Примечание – р – достоверность различий между показателями инфицированности
D.folliculorum до терапии и через месяц после ее окончания
~82 ~
При этом у пациентов с легкой степенью тяжести ППР элиминация клеща достигнута у одинакового количества вне зависимости от получаемой терапии. В группе пациентов со средней степенью тяжести ППР, получавших комбинированное лечение по оригинальной схеме, D. folliculorum был санирован у 10 обследуемых, а получавших стандартную терапию – у 8, что достоверно отличалось от результатов до назначения терапии (р<0,05). У пациентов с тяжелой степенью тяжести ППР стандартная терапия приводила к элиминации клеща у 46,2%, а комбинированное лечение по оригинальной схеме – у 66,7% инфицированных пациентов (таблица 6.2). Следовательно, достижение лучшей элиминации D. folliculorum у пациентов, получавших комбинированное лечение, не имеющее антипаразитарной активности, позволяет заключить, что роль клеща в патогенезе ППР не является ключевой. Данный сапрофит может лишь осложнять течение дерматоза при развитии необходимых для его жизнедеятельности условий на коже, что согласуется с современными литературными данными [8, 35, 37, 72, 149].
6.3 Сравнительная оценка показателей прооксидантноантиокcидантного гомеостаза у пациентов с папулопустулезной формой розацеа в динамике комбинированной терапии
Для оценки лабораторной эффективности разработанного метода комбинированного лечения по оригинальной схеме у всех пациентов с ППР через месяц после окончания терапии проводилось определение показателей прооксидантноантиоксидантного гомеостаза (таблица 6.3).
В группе пациентов с легкой степенью тяжести ППР, получавших стандартное лечение (подгруппа 1А), отмечалась тенденция к повышению как первичных (ДК), так и вторичных (МДА) продуктов ПОЛ в плазме крови и эритроцитарной массе по сравнению с показателями до лечения, что указывает на продолжение пероксидации липидов и утяжеление имеющихся нарушений, несмотря на проводимую терапию. Стандартная терапия не оказывала влияния на уровень каталазы и восстановленного глутатина. Концентрация неферментативного антиоксиданта церулоплазмина имела тенденцию к снижению по
~ 83 ~

сравнению с ее уровнем до лечения. Следует отметить, что активность СОД после проведенной традиционной терапии стала достоверно выше по сравнению с результатами до лечения. Однако незначительное повышение ее активности после лечения не приводило к существенному усилению антиоксидантной защиты, что подтверждалось дальнейшим накоплением первичных и вторичных продуктов пероксидации липидов в крови у пациентов данной подгруппы, а также несущественным регрессом клинических проявлений. Традиционное лечение не оказывало влияния на уровень общих нитрат/нитритов (таблица 6.3).
Таблица 6.3. – Значения лабораторных показателей, характеризующих состояние прооксидантно-антиоксидантного дисбаланса, у пациентов с легкой степенью тяжести ППР до лечения и через 1 месяц после окончания терапии, Me (25%; 75%)
|
|
Подгруппа |
|
|
||
Показатель |
до лечения |
через месяц |
|
|||
после окончания лечения |
||||||
|
|
|
||||
|
1А (n=21) |
1Б (n=21) |
1А (n=21) |
1Б (n=21) |
||
ДК (эритроциты), |
9,07 |
9,48 |
9,16 |
9,03* |
||
ед/мл |
(7,68; 12,36) |
(7,37; 12,60) |
(7,38; 11,78) |
(7,31; 12,02) |
||
ДК (плазма), |
1,10 |
1,22 |
1,02 |
1,17 |
||
ед/мл |
(0,36; 1,80) |
(0,44; 1,54) |
(0,41; 1,82) |
(0,52; |
1,63) |
|
МДА (эритроциты), |
9,04 |
9,70 |
9,45 |
9,71* |
||
мкмоль/л |
(8,57; 10,10) |
(8,34; 11,04) |
(8,77; 10,34) |
(8,54; 11,12) |
||
|
|
|
|
|
||
МДА (плазма), |
1,41 |
1,68 |
1,54 |
1,62 |
||
мкмоль/л |
(1,18; 1,97) |
(1,28; 1,97) |
(1,26; 1,92) |
(1,24; |
1,89) |
|
Каталаза, |
30,66 |
29,13 |
30,22 |
30,18 |
||
ммоль Н2О2/мин/г |
(27,85; 31,67) |
(28,10; 31,45) |
(28,32; 31,89) |
(27,46; |
32,38) |
|
Восстановленный |
24,47 |
23,17 |
24,56 |
23,52 |
||
глутатион, |
||||||
(19,95; 27,58) |
(19,14; 25,66) |
(20,95; 27,98) |
(17,56; |
26,92) |
||
мкмоль/г Нв |
||||||
|
|
|
|
|
||
СОД, % |
41,0 |
43,0 |
44,0* |
47,0* |
||
(33,0; 46,0) |
(33,0; 53,0) |
(41,0; 49,0) |
(37,0; |
56,0) |
||
|
||||||
|
|
|
|
|
||
Церулоплазмин, мг/л |
103,0 |
106,0 |
98,0 |
116,0* |
||
(83,0; 135,0) |
(89,0; 126,0) |
(82,0;143,0) |
(93,0; 132,0) |
|||
|
||||||
Нитрат/нитриты, |
10,29 |
10,05 |
9,84 |
9,19* |
||
мкмоль/л |
(8,65; 14,76) |
(8,11; 12,62) |
(8,30; 15,58) |
(7,82;10,98) |
||
Ретинол, |
0,98 |
1,09 |
1,07 |
1,16 |
||
мкмоль/л |
(0,92; 1,27) |
(0,91; 1,27) |
(0,84; 1,22) |
(0,83; |
1,29) |
|
α-токоферол, |
18,94 |
16,94 |
17,22 |
16,11 |
||
мкмоль/л |
(12,0; 22,81) |
(4,17; 18,65) |
(14,57; 21,84) |
(14,11; |
18,99) |
|
Примечание – * – различия показателей в пределах одной подгруппы до лечения и через месяц после его окончания достоверны (p<0,05)
~ 84 ~
Упациентов подгруппы 1Б, в качестве лечения получающих фототерапию, состояние окислительного стресса улучшалось за счет достоверного снижения концентрации ДК и МДА в эритроцитарной массе. Установлено достоверное повышение концентрации и активности основных компонентов антиоксидантной защиты (церулоплазмин, СОД), наметилась тенденция к повышению уровня каталазы и восстановленного глутатиона. При проведении дифференцированной терапии достоверно снижался уровень суммарных нитрат/нитритов, хотя показатели липорастворимых антиоксидантов до и после лечения не различались в обеих подгруппах (таблица 6.3).
Упациентов со средней степенью тяжести ППР, получавших стандартное лечение (подгруппа 2А), отмечалась тенденция к снижению первичных и вторичных продуктов ПОЛ в плазме крови
иэритроцитарной массе по сравнению с показателями до лечения, но достоверных различий не выявлено. Стандартная терапия не оказывала влияния на концентрацию компонентов антиоксидантной защиты, что подтверждалось отсутствием изменений показателей изучаемых антиоксидантов до и после лечения. Уровень суммарных нитрат/нитритов после проведенной традиционной терапии достоверно не отличался от такового до лечения (таблица 6.4).
Применение комбинированного метода лечения по оригинальной схеме у пациентов подгруппы 2Б привело к улучшению состояния возникшего ранее окислительного стресса за счет снижения концентрации как первичных (ДК), так и вторичных (МДА) продуктов пероксидации липидов в эритроцитарной массе. При этом отмечалось достоверное повышение концентрации компонентов антиоксидантной защиты (СОД, каталаза, церулоплазмин). Кроме того, уровень суммарных нитрат/нитритов достоверно снизился и достиг нормальных значений. Однако значения липорастворимых антиоксидантов до и после лечения достоверно не разичались в обеих подгруппах (таблица 6.4).
~85 ~

Таблица 6.4. – Значения лабораторных показателей, характеризующих состояние прооксидантно-антиоксидантного дисбаланса, у пациентов со средней степенью тяжести ППР до лечения и через 1 месяц после окончания терапии, Me (25%; 75%)
|
|
Подгруппа |
|
|
|
||
Показатель |
до лечения |
|
через месяц |
|
|||
после окончания лечения |
|||||||
|
|
|
|||||
|
2А (n=24) |
2Б (n=25) |
2А (n=24) |
2Б (n=25) |
|||
ДК (эритроциты), |
11,08 |
12,48 |
10,16 |
11,52* |
|||
ед/мл |
(8,74; 13,56) |
(10,56; 13,44) |
(9,16; 12,03) |
(9,87; 12,41) |
|||
|
|
|
|
|
|||
ДК (плазма), |
0,94 |
0,92 |
0,93 |
0,92 |
|||
ед/мл |
(0,78; 1,26) |
(0,72; 1,06) |
(0,80; |
1,25) |
(0,76; |
1,43) |
|
|
|
|
|
|
|
|
|
МДА |
10,39 |
10,78 |
9,22 |
9,89* |
|||
(эритроциты), |
|||||||
(9,20; 11,05) |
(9,21; 12,62) |
(8,75; 10,83) |
(8,96;11,64) |
||||
мкмоль/л |
|||||||
|
|
|
|
|
|
||
МДА (плазма), |
1,52 |
1,81 |
1,62 |
1,89 |
|||
мкмоль/л |
(1,37; 2,01) |
(1,55; 1,97) |
(1,24; |
1,93) |
(1,54; |
1,98) |
|
Каталаза, |
30,22 |
28,08 |
29,28 |
29,03* |
|||
ммоль Н2О2/мин/г |
(25,71; 31,17) |
(25,35; 29,04) |
(28,06; |
33,09) |
(27,43; |
31,24) |
|
|
|
|
|
|
|
|
|
Восстановленный |
26,60 |
24,58 |
27,67 |
24,12 |
|||
глутатион, |
|||||||
(18,96; 32,15) |
(18,71; 32,14) |
(18,76; |
32,10) |
(18,28; |
31,66) |
||
мкмоль/г Нв |
|||||||
|
|
|
|
|
|
||
СОД, % |
38,0 |
39,0 |
42,0 |
44,0* |
|||
(31,65; 50,0) |
(28,0; 50,0) |
(33,5; |
49,0) |
(33,0; |
52,0) |
||
|
|||||||
Церулоплазмин, |
86,5 |
94,0 |
90,5 |
112,0* |
|||
мг/л |
(56,5; 120,0) |
(63,0;111,0) |
(53,50; |
110,0) |
(94,0; 127,0) |
||
Нитрат/нитриты, |
13,93 |
12,81 |
12,55 |
9,63* |
|||
мкмоль/л |
(9,33; 16,43) |
(9,69; 15,43) |
(9,67; 15,11) |
(8,42; 12,14) |
|||
Ретинол, |
1,25 |
1,24 |
1,18 |
1,29 |
|||
мкмоль/л |
(0,90; 1,78) |
(1,10; 1,57) |
(0,86;1,76) |
(1,12; |
1,42) |
||
α-токоферол, |
18,25 |
17,99 |
18,43 |
18,54 |
|||
мкмоль/л |
(13,87; 23,62) |
(13,53; 25,34) |
(13,34; |
24,57) |
(15,74; |
24,68) |
|
Примечание – * – различия показателей в пределах одной подгруппы до лечения и через месяц после его окончания достоверны (p<0,05)
Стандартная терапия не оказывала влияния на все показатели прооксидантно-антиоксидантного гомеостаза у пациентов с тяжелой степенью тяжести ППР (таблица 6.5).
У пациентов в подгруппе 3Б комбинированное лечение по оригинальной схеме приводило к улучшению состояния окислительного стресса за счет достоверного снижения концентрации ДК в плазме крови по сравнению с результатами до
~ 86 ~
лечения. Под влиянием оптимизированной терапии отмечалось достоверное повышение концентрации церулоплазмина и снижение уровня суммарных нитрат/нитритов. Значения липорастворимых антиоксидантов до и после лечения достоверно не различались в обеих подгруппах у пациентов с тяжелой степенью тяжести ППР (таблица 6.5).
Таблица 6.5. – Значения лабораторных показателей, характеризующих состояние прооксидантно-антиоксидантного дисбаланса, у пациентов с тяжелой степенью тяжести ППР до лечения и через 1 месяц после окончания терапии, Me (25%; 75%)
|
|
Подгруппа |
|
|
||
|
|
|
|
|
||
Показатель |
до лечения |
через месяц после окончания |
||||
|
лечения |
|||||
|
|
|
|
|||
|
|
|
|
|
||
|
3А (n=18) |
3Б (n=19) |
3А (n=18) |
3Б (n=19) |
||
|
|
|
|
|
||
ДК (эритроциты), |
12,42 |
13,32 |
12,09 |
10,83* |
||
ед/мл |
(9,76; 15,72) |
(10,48; 15,72) |
(10,08; 14,98) |
(8,92; 13,89) |
||
ДК (плазма), |
1,08 |
1,04 |
1,10 |
0,92* |
||
ед/мл |
(0,80; 1,48) |
(0,78; 1,60) |
(0,79;1,38) |
(0,72; 1,32) |
||
|
|
|
|
|
||
МДА |
11,81 |
9,99 |
11,27 |
9,43 |
||
(эритроциты), |
(10,52; 14,15) |
(9,10;1 3,51) |
(10,08; |
12,88) |
(7,98; 13,92) |
|
мкмоль/л |
|
|
|
|
|
|
МДА (плазма), |
1,62 |
1,62 |
1,68 |
1,52* |
||
мкмоль/л |
(1,27; 2,42) |
(1,13; 2,54) |
(1,22; |
2,66) |
(1,1; 2,02) |
|
Каталаза, |
27,53 |
28,06 |
27,63 |
28,14 |
||
ммоль Н2О2/мин/г |
(25,36; 28,72) |
(25,10; 30,37) |
(24,88; |
29,73) |
(24,87; 30,90) |
|
Восстановленный |
27,44 |
30,07 |
28,56 |
28,62 |
||
глутатион, |
(19,20; 33,68) |
(20,0; 34,38) |
(22,38; |
30,82) |
(20,92; 36,24) |
|
мкмоль/г Нв |
|
|
|
|
|
|
СОД, % |
36,50 |
36,0 |
38,50 |
38,0 |
||
(28,0; 50,0) |
(28,0; 44,0) |
(28,0; |
44,0) |
(29,0; 44,0) |
||
|
||||||
Церулоплазмин, |
75,5 |
79,0 |
72,50 |
112,0* |
||
мг/л |
(51,0; 98,0) |
(47,0; 98,0) |
(62,0; |
98,0) |
(96,0; 126,0) |
|
Нитрат/нитриты, |
14,80 |
15,09 |
14,88 |
10,84* |
||
мкмоль/л |
(10,95; 18,26) |
(11,17; 18,38) |
(13,86; |
16,24) |
(8,87; 12,44) |
|
Ретинол, |
0,98 |
1,12 |
0,91 |
1,24 |
||
мкмоль/л |
(0,75; 1,21) |
(0,78; 1,55) |
(0,79; |
1,32) |
(0,76; 1,41) |
|
α-токоферол, |
14,05 |
14,3 |
13,13 |
14,55 |
||
мкмоль/л |
(10,37; 20,18) |
(10,2; 21,26) |
(12,32; |
22,10) |
(10,12; 22,43) |
|
Примечание – * – различия показателей в пределах одной подгруппы до лечения и через месяц после его окончания достоверны (p<0,05)
~ 87 ~

6.4 Сравнительная оценка содержания VEGF и провоспалительных цитокинов у пациентов с папулопустулезной формой розацеа в динамике комбинированной терапии
Для оценки состояния медиаторов неоангиогенеза и иммунных процессов через месяц после окончания терапии проводилось определение концентрации VEGF и провоспалительных цитокинов (ИЛ-1β, ИЛ-6, ФНО-α).
После фотолечения у пациентов с легкой степенью тяжести ППР отмечалось достоверное снижение уровней VEGF, ИЛ-1β и ФНО-α, концентрации которых достигали нормальных значений. Стандартная терапия в 1А подгруппе не оказывала влияния на уровень VEGF и показатели цитокинового статуса (таблица 6.6). Таким образом, использование терапии синим и красным светом было эффективным и безопасным методом лечения легкой степени тяжести ППР, что подтверждалось нивелированием кожных проявлений и лабораторными показателями.
Таблица 6.6. – Значения VEGF, ИЛ-1β, ИЛ-6, ФНО-α у пациентов с легкой степенью тяжести ППР до лечения и через 1 месяц после окончания терапии, Me (25%; 75%)
|
|
|
Подгруппа |
|
|
Показатель |
|
|
|
|
|
до лечения |
|
через месяц после окончания |
|||
(пг/мл) |
|
лечения |
|||
|
|
|
|||
|
|
|
|
|
|
|
1А (n=21) |
1Б (n=21) |
1А (n=21) |
1Б (n=21) |
|
|
|
|
|
|
|
VEGF |
88,13 |
92,33 |
88,76 |
78,24* |
|
|
(79,36; 107,66) |
(58,06; |
129,2) |
(74,99; 118,29) |
(62,06; 108,76) |
ИЛ-1β |
3,82 |
3,59 |
3,34 |
3,24* |
|
|
(3,52; 4,18) |
(3,32; |
3,88) |
(3,16; 4,12) |
(3,12; 3,88) |
ИЛ-6 |
1,47 |
1,41 |
1,43 |
1,24 |
|
|
(0,91; 1,64) |
(1,19; |
1,56) |
(0,86; 1,92) |
(1,02; 1,32) |
ФНО-α |
1,76 |
1,74 |
1,73 |
1,46* |
|
|
(1,48; 1,95) |
(1,48; |
1,86) |
(1,24; 1,98) |
(1,36; 1,71) |
Примечание – * – различия показателей в пределах одной подгруппы до лечения и через месяц после его окончания достоверны (p<0,05)
У пациентов со средней степенью тяжести ППР (подгруппа 2Б), получавших комбинированное лечение по оригинальной схеме,
~ 88 ~
установлено достоверное снижение концентрации VEGF, ИЛ-1β, ФНО-α. Стандартная терапия, проводимая в подгруппе 2А, приводила к достоверному снижению только ФНО-α (таблица 6.7).
Таблица 6.7. – Значения VEGF, ИЛ-1β, ИЛ-6, ФНО-α у пациентов со средней степенью тяжести ППР до лечения и через 1 месяц после окончания терапии,
Me (25%; 75%)
|
|
Подгруппа |
|
||
Показатель |
|
|
|
|
|
до лечения |
через месяц |
||||
|
|||||
(пг/мл) |
после окончания лечения |
||||
|
|
||||
|
|
|
|||
|
|
|
|
|
|
|
2А (n=24) |
2Б (n=25) |
2А (n=24) |
2Б (n=25) |
|
|
|
|
|
|
|
VEGF |
95,98 |
116,14 |
87,33 |
87,63** |
|
|
(72,68; 124,88) |
(96,87; 136,51) |
(70,64; 103,31) |
(74,78; 108,86) |
|
ИЛ-1β |
4,05 |
3,96 |
4,38 |
3,76* |
|
|
(3,52; 4,81) |
(3,52; 4,24) |
(3,34; 4,78) |
(3,36; 4,14) |
|
ИЛ-6 |
1,75 |
1,28 |
1,55 |
1,12 |
|
|
(1,29; 2,2) |
(0,91; 1,76) |
(1,19; 2,03) |
(0,86; 1,52) |
|
ФНО-α |
1,96 |
1,72 |
1,78* |
1,74* |
|
|
(1,57; 2,38) |
(1,46; 2,25) |
(1,43; 2,0) |
(1,32; 2,04) |
|
Примечание – * – различия показателей в пределах одной подгруппы до лечения и через месяц после его окончания достоверны (p<0,05)
У пациентов в подгруппе 3Б наблюдалось достоверное снижение концентрации VEGF и ФНО-α. Уровни ИЛ-1β и ИЛ-6 снизились незначительно. Стандартная терапия в подгруппе 3А не приводила к достоверному снижению изучаемых иммунологических показателей (таблица 6.8).
~ 89 ~

Таблица 6.8. – Значения VEGF, ИЛ-1β, ИЛ-6, ФНО-α у пациентов с тяжелой степенью тяжести ППР до лечения и через 1 месяц после окончания терапии, Me (25%; 75%)
|
|
|
Подгруппа |
|
|
|
|
|
|
|
|
Показатель |
до лечения |
|
через месяц |
||
(пг/мл) |
|
после окончания лечения |
|||
|
|
|
|||
|
3А (n=18) |
3Б (n=19) |
3А (n=18) |
3Б (n=19) |
|
|
|
|
|
|
|
VEGF |
126,54 |
121,16 |
110,51 |
84,56*** |
|
|
(108,4; 137,81) |
(103,99; |
150,37) |
(92,56; 132,78) |
(74,82; 104,86) |
ИЛ-1β |
4,25 |
4,04 |
4,11 |
4,18 |
|
|
(4,03; 4,96) |
(3,65; |
4,72) |
(3,78; 4,82) |
(3,56; 4,46) |
ИЛ-6 |
2,11 |
1,47 |
1,88 |
1,25 |
|
|
(1,54; 2,42) |
(0,91; |
2,26) |
(1,34; 2,24) |
(0,89; 1,86) |
ФНО-α |
2,19 |
2,29 |
1,96 |
1,88* |
|
|
(1,66; 2,36) |
(1,5; 2,82) |
(1,76; 2,38) |
(1,56; 2,44) |
|
Примечание – * – различия показателей в пределах одной подгруппы до лечения и через месяц после его окончания достоверны (p<0,05)
6.4 Рекомендации по практическому использованию метода определения степени тяжести и алгоритма лечения ППР
Нами разработана дифференцированная схема лечебнодиагностических мероприятий у женщин с ППР, которая преследует цель повысить эффективность лечения ППР посредством введения дополнительных клинико-лабораторных критериев для объективизации оценки степени тяжести ППР с последующим проведением комбинированного лечения, включающего назначение фототерапии, топических средств азелаиновой кислоты и антибиотика по оригинальной схеме.
Применение данного метода будет полезным специалистам фундаментального и прикладного профиля: врачамдерматовенерологам, врачам-косметологам, а также студентам всех факультетов медицинских ВУЗов, изучающим вопросы диагностики и лечения ППР.
Рекомендуется для использования в стационарных и амбулаторно-поликлинических отделениях городских, областных и республиканских кожно-венерологических учреждений (диспансеров), консультативных диагностических центрах, в которых проводится оказание медицинской помощи пациентам с ППР.
~ 90 ~
