
4 курс / Дерматовенерология / ЭСТЕТИЧЕСКАЯ_МЕДИЦИНА_3_ОТ_2019_ГОДА
.pdf
ковой природы, количество которых изменяется |
дермы тонкий, представлен рыхлой волокнистой |
|
с формированием основных патофизиологических |
соединительной тканью с очаговой гомогенизаци- |
|
слагаемых процесса старения. За последние 15 |
ей волокон (набухание, дистрофические измене- |
|
лет развитие методов иммуногистохимии позволи- |
ния). Сетчатый слой дермы относительно тонкий, с |
|
ло вывести на новый уровень поиск и валидацию |
умеренным |
количеством волосяных фолликулов, |
новых биохимических, молекулярно-генетических |
со скудной |
перифолликулярной круглоклеточной |
биомаркеров старения человека [3]. Идеальным |
инфильтрацией единичных сальных желез и оча- |
|
биомаркером было бы синтезируемое в организ- |
говым полнокровием микроциркуляторного русла, |
|
ме вещество, концентрация которого отражала бы |
фибробласты преимущественно мелких размеров в |
|
нарастание процессов, связанных со старением, |
умеренном количестве. |
|
например дермы. Однако появление такого одного- |
|
|
единственного маркера маловероятно, и в практике |
|
|
интерпретации молекулярно-биологических данных |
|
|
приходится опираться на пул нескольких биомарке- |
|
|
ров. То есть измеряемых параметров должно быть |
|
|
много, и чем их больше, тем более объективную |
|
|
оценку влияния тех или иных препаратов на проте- |
|
|
кание процессов старения можно получить. |
|
|
2 МАТЕРИАЛЫ И МЕТОДЫ
Методами иммуногистохимии |
(иммунофлюорес- |
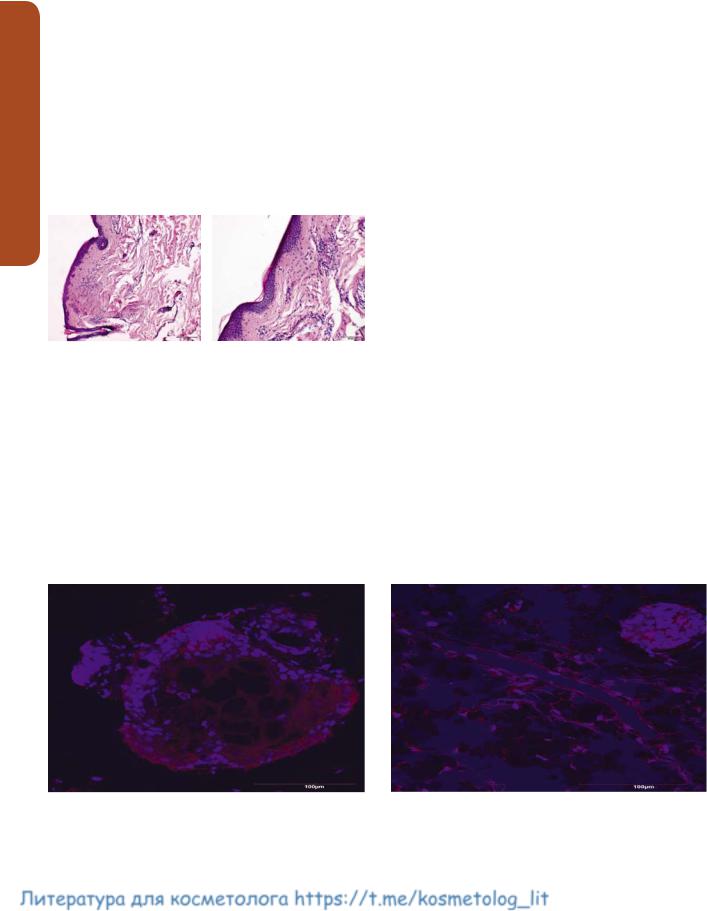
Рис. 1. Образец №1, микропрепарат. Окраска |
|
гематоксилином и эозином, ув. Х100 |
|||
центного анализа) изучали динамику экспрессии |
|
||
клетками кожи генов нейроэндокринных биомар- |
|
||
керов. Экспрессия различных генов клеткой – |
Образец №2 (рис. 2). Этот кожный лоскут также |
||
основополагающий процесс, управляющий всеми |
покрыт многослойным плоским ороговевающим |
||
функциями клетки. Объектом исследования служил |
эпителием типичного строения с сохранением всех |
||
биологический материал, полученный от 48-летней |
слоев и мелкоочаговой гиперпигментацией базаль- |
||
пациентки при пластической операции круговой |
ного слоя. Сосочковый слой дермы относительно |
||
подтяжки лица, и 52-летней пациентки после опе- |
тонкий, представлен рыхлой волокнистой соедини- |
||
рации блефаропластики нижних век. Исследовали |
тельной тканью. Сетчатый слой широкий, взят до |
||
образцы (биоптаты) кожи, в которую предваритель- |
подкожно-жировой клетчатки. Коллагеновые и эла- |
||
но были введены гидрогелевые материалы гиалу- |
стиновые волокна формируют сеть. Фибробласты |
||
роновой кислоты (состав образцов для исследо- |
типового строения в умеренном количестве. |
||
вания: образец №1 – «Голдгиал» – гиалуроновая |
Небольшое количество потовых желез. |
||
кислота (10 мг/мл) + золь золота (15 мкг/мл) + |
|
||
таурин и глицин (вспомогательные аминокислоты, |
|
||
стабилизирующие наночастицы |
золота); образец |
|
|
№2 – «Контургель-ХПМ» – гиалуроновая кисло- |
|
||
та (8–10 мг/мл); образец №3 – интактная кожа |
|
||
(контроль)). Введение препаратов осуществляли по |
|
||
стандартной методике биоревитализации (4 инъек- |
|
||
ции через каждые 14 дней). |
|
|
|
Описание образцов |
|
|
|
Образец №1 (рис. 1). В срезе представлена кожа |
|
||
с тонким роговым слоем. Кожный лоскут покрыт |
|
||
многослойным плоским ороговевающим эпители- |
Рис. 2. Образец №2, микробиоптат кожи |
||
ем типичного строения с сохранением всех слоев, |
|||
человека. Окраска гематоксилином и эозином, ув. |
|||
с единичными меланоцитами. Сосочковый слой |
|||
Х100 |
|||
НАУЧНЫЕ ИССЛЕДОВАНИЯ
Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019 281
НАУЧНЫЕ ИССЛЕДОВАНИЯ
Образец №3 (интактная кожа) (рис. 3). Эпидермис типового строения с сохранением всех слоев, неравномерной толщины с единичными мелкими полиповидными выпячиваниями, очаговый умеренно выраженный акантоз, диффузная гиперпигментация базального слоя. В нижних отделах сосочкового слоя дермы определяются меланоциты (пигментные пятна) и эозинофилы (до 5 в поле зрения). Наблюдается перифолликулярная, местами выраженная круглоклеточная инфильтрация. Сетчатый слой дермы рыхлый с неравномерным интерстициальным отеком.
а |
б |
Рис. 3. Образец №3 (контроль). Микропрепарат. Фрагмент кожи, ув. Х100 (а); фрагмент кожи (меланоциты и эозинофилы), ув. Х200 (б). Окраска гематоксилином и эозином
Определяемые биомаркеры
Для иммуногистохимического исследования (ИГХ) использовали следующие первичные моноклональные антитела к белкам: procollagen I, MMP-9, ММР-13, TGF-b, Klotho, кальретикулин, BCL-2, p53, АР-1, VEGF, VEGFR, SIRT-1. В качестве контроля проводили иммунофлуоресцентную реакцию без первичных антител. Специфичность антител под-
а
тверждали в контрольных экспериментах. Оценку иммунофлюоресцентной реакции проводили на конфокальном лазерном сканирующем микроскопе Olympus FlueView1000 (Olympus, Япония) с использованием программы Morphology 5.0 (Видеотест, Россия). В каждом случае анализировали 5 полей зрения при увеличении Х400. Определяли относительную площадь экспрессии (количества) в %, рассчитывая ее как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали ее в процентах как для маркеров с цитоплазматическим, так и с ядерным окрашиванием (рис. 4).
Статистическая обработка результатов
Статистическую обработку проводили в программе Excel 2007, Microsoft Office и в аналитической программе Statistica 13.3. Статистическая обработка всех экспериментальных данных включала подсчет среднего арифметического, стандартного отклонения и доверительного интервала для каждой выборки. Для анализа вида распределения использовали критерий Шапиро– Уилка (W-test). Для проверки статистической однородности нескольких выборок использовали непараметрические процедуры однофакторного дисперсионного анализа (критерий Крускалла– Уоллиса). Для выборок, где разброс был значительным, применяли процедуры множественных сравнений с помощью критерия Манна–Уитни. Для групп с незначительным разбросом применяли t-критерий Стьюдента. Критический уровень достоверности нулевой гипотезы (об отсутствии различий) принимали равным 0,01.
б
Рис. 4. Экспрессия MMP-9 в клетках кожи в образцах №1 (а) и №3 (б). Иммунофлюоресцентный конфокальный микроскоп, ув. Х400. Для окрашивания ядер использован Hoechst 33258 (синяя флюоресценция). Визуализация белка проведена с помощью вторичных антител, конъюгированных с Alexa Fluor 647 (красная флюоресценция)
282 Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019

3 РЕЗУЛЬТАТЫИ ОБСУЖДЕНИЕ
Один из первых признаков старения кожи – нарушение ее эластичности, связанное как с возрастной деградацией тканей, так и с воздействием негативных факторов внешней среды. Разбалансировка синтеза и распада коллагеновых белков, нарушение процесса апоптоза, истощение потенциала стволовых клеток, которое способствует нарушению их дифференцировки, – все это приводит к снижению регенеративной способности межклеточного матрикса дермы. Снижение регенеративного потенциала кожи – одна из важнейших характеристик старения ткани.
Межклеточныйматрикссостоитизбольшогоколичества компонентов, которые обусловливают жесткость, подвижность и упругость кожи. Ремоделирование дермы осуществляется не только в результате ее активного физиологического функционирования, но и в процессе синтеза/распада (обновления, турновера) всех структурных компонентов. Процессы деградации структур межклеточного матрикса – важная составная часть физиологического ремоделирования ткани. Коллагеновые белки постоянно повреждаются свободными радикалами, реакциями неферментативного гликирования (присоединения остатков глюкозы к амнокислотным остаткам белков), карбамилирования, билирубинирования, протеолиза. Эти изменения приводят к нарушению взаимодействия и ориентации макромолекул. В зонах повреждений активируются
металлопротеиназы (ММР), которые разрушают неправильно структурированные или ориентированные макромолекулы.
Однако функции ММР не ограничиваются только ремоделированием межклеточного матрикса путем его разрушения, как это предполагалось до недавнего времени. Эксперименты на животных свидетельствуют, что, действуя на различные субстраты, разные ферменты семейства ММР участвуют в регуляции таких физиологических процессов, как морфогенез, резорбция и ремоделирование тканей, ангиогенез, миграция, белковая адгезия [4–6]. Так, повышенная активность MMP-9 отмечена при ремоделировании ткани и ее репарации, мобилизации матрикссвязанных факторов роста и процессинге цитокинов [7]. Экспериментально доказанный рост активности протеиназ [2], в частности ММР-9, в коже, подвергнутой хроно- и УФ-старению, связан с утилизацией повреждений желатинизированного коллагена и способствует качественному ремоделированию межклеточного матрикса дермы. Считается [2], что уровень содержания некоторых внеклеточных металлопротеиназ может служить мерой старения ткани. На сегодняшний день известны около 30 протеолитических ферментов [2], из которых ММР-1,3,13 разрушают большинство коллагеновых белков I, II, III, IV, IX, X типов. С возрастом продукция коллагена значительно снижается, а уровень его деградации растет, что не в последнюю очередь связано с ростом экспрессии гена, кодирующего синтез ММР-13.
Ниже представлены экспериментальные результаты сравнения относительной площади экспрессии различных биомаркеров в изучаемых образцах. Фактически полученная информация отражает скорость накопления тех или иных белковых молекул в образцах кожи.
НАУЧНЫЕ ИССЛЕДОВАНИЯ
Рис. 5. Относительные площади экспрессии маркеров BCL2, ММР-9, ММР-13, проколлаген-I, VEGF, VEGFR, Sirt 1; кальретикулин, Р 53 в образцах кожи 1 (синие столбики) и 3 (контроль, зеленые столбики)
Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019 283

НАУЧНЫЕ ИССЛЕДОВАНИЯ
Внашем исследовании экспериментально зафиксировано, что в образцах кожи после введения гиалуронанового гидрогеля с наночастицами золота количество ММР-13 снизилось в сравнении с контролем в 3,5 раза (рис. 5), при этом количество ММР-9 в тех же образцах, напротив, увеличилось почти в 3,5 раза. Это очень важный результат, который может свидетельствовать о возникновении процессов, тормозящих старение кожи, при введении в
нее соответствующих препаратов (в данном случае гиалуронанового гидрогеля с наночастицами золота).
Врезультате протекания процессов старения
вдерме происходит снижение уровня экспрессии белка проколлагена-1. По результатам настоящего исследования уровень его экспрессии при введении препарата «Голдгиал» (образец №1) возрастает 1,7 раза (см. рис. 5).
Белки BCL2 и р53 относятся к ферментам, контролирующим процессы клеточного апоптоза. В быстро делящихся (пролиферирующих) клетках происходит увеличение концентрации белка р53, что говорит о подготовке клетки для быстрой реакции на возможные повреждения ДНК. При стимуляции пролиферативной активности фибробластов, например при инъекционном введении препаратов, для остановки клеточного цикла требуется более высокая концентрация белка р53. Это особенно важно принимать во внимание, так как хроническое накопление неправильно свернутых (с нарушением фолдинга) белковых макромолекул провоцирует развитие ассоциированных со старением патологий. Активированный белок р53 супрессирует транскрипцию ряда генов. Гены, транскрипцию которых контролирует р53, кодируют белковые компоненты апоптотической программы и белки, которые регулируют клеточный цикл. Установлено, что
активация р53 происходит, в частности, в результате нарушения клеточной адгезии и фокальных контактов
всистеме «межклеточный матрикс» / «клетка» [2]. Действуя сразу по нескольким механизмам, р53 осуществляет как быструю реакцию на сильные стрессы, так и регулировку программы апоптоза поврежденных клеток. Это предотвращает накопление мутаций
вклеточной популяции и обеспечивает генетическую стабильность. Кроме того, белок p53 относится к важным маркерам старения [8].
Настоящее исследование показало, что введение
вкожу препаратов на основе гиалуроновой кислоты увеличивает экспрессию генов, кодирующих синтез белка р53. При этом наибольшую эффективность продемонстрировал препарат «Голдгиал» с наночастицами золота: при его введении экспрессия данных генов оказалась в 2,5 раза выше, чем при введении «Контургеля-ХПМ», и почти в 7 раз выше, чем в контрольном образце кожи, куда препараты не вводили (рис. 6).
Роль белка BCL2 в процессах клеточного старения дермы не совсем ясна [3 ,9]. По некоторым данным, в тех случаях, когда экспрессия этого белка была низка
или не была обнаружена, отмечался рост апоптоза. Фактор TGF-β – белок, который производится
и секретируется большинством клеток организма, включая клетки иммунной системы, и имеет множество функций. В частности, важна его роль в инициации неоколлагеногенеза (то есть синтеза коллагена de novo). В прямом смысле слова этот биополимер нельзя отнести к маркерам старения, но связь этого фактора с другими биомаркерами клеточного старения вполне очевидна [3]. Относительно недавно
было установлено, что, активируясь при кожных патологиях, TGF-β индуцирует экспрессию гликолитиче-
Рис. 6. Относительные площади экспрессии маркеров ММР-9, TGF-b, Klotho, кальретикулин, р53, АР-1 в образцах кожи №1 («Голдгиал», синие столбики), №2 («Контургель-ХПМ», красные столики), №3 (интактная кожа, зеленые столбики)
284 Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019

ских генов и способствует усилению гликолитических потоков [10]. Он также индуцирует активность ферментов PHGDH, PSAT1, PSPH и SHMT2, необходимых для синтеза аминокислот серина и глицина, служащих исходным материалом для синтеза коллагена.
Мы выяснили, что в образцах кожи с введенным препаратом «Голдгиал» экспрессия гена, кодирующего синтез трансформирующего ростового фактора TGF-β, в 4 раза выше, чем в образцах, куда был введен «Контургель-ХПМ», и в 6 раз выше, чем в контроле (интактной коже) (рис. 6).
Клото (Klotho) – трансмембранный белок, присутствие которого замедляет старение организма [11]. На моделях мышей было показано, что искусственно повышенная активность гена белка Клото приводила к увеличению продолжительности жизни животных на 20–30% [12]. Внутри клетки белок Клото подавляет активность гена WNT – одного из главных геновтриггеров процесса саморазрушения и истощения клеток [13], что напрямую связано со старением тканей [14]. В отношении его влияния на старение фибробластов в настоящий момент известно, что Kлото замедляет клеточное старение в первичных клетках фибробласта человека и эндотелиальных клетках. Потеря активности Клото приводит к развитию в первичных клетках фибробластов фенотипа преждевременного старения. С возрастом в организме отмечается недостаток белка Клото, что фенотипически проявляется, в частности, атрофией кожи.
Влитературе мало статей, посвященных влиянию этого белка на процессы старения фибробластов. Однако имеющиеся данные свидетельствуют
отом, что Клото может быть важной терапевтической мишенью, воздействие на которую сможет оказать влияние на процессы старения человеческого организма. По результатам данного исследования в образцах кожи, содержащих гидрогель с наночастицами золота, уровень экспрессии Клото-белка почти в 3,5 раза выше, чем в образцах, куда был введен препарат «Контургель-ХПМ», и в 4,3 раза выше, чем в контроле (интактной коже) (см. рис. 6).
Висследованных биоптатах кожи одни из самых высоких уровней экспрессии были зафиксированы для белка кальретикулина. При этом различий в значениях этого показателя в изучаемых образцах с введенными гиалуронановыми гидрогелями установлено не было. Однако в контрольном образце (интактной коже) относительная площадь экспрессии этого биомаркера оказалась почти на 50% ниже, чем в образцах №1 и №2 (см. рис. 6). Кальретикулин – маркер эндоплазматического ретикулума (ЭР), многофункциональный кальцийсвязывающий белок. Кроме регуляции внутриклеточной концентрации
кальция, этот белок обладает функциями шаперона и вместе с кальнексином принимает участие в формировании третичной структуры белков. Кальретикулин связывается с неправильно свернутыми белками и гликопротеинами и предотвращает их транспорт из ЭР к аппарату Гольджи. Было показано, что содержание кальретикулина в мозге мышей при их старении постоянно снижается. Снижение с возрастом содержания кальретикулина вызывает снижение контроля качества белка, что приводит к различным деструктивным изменениям [15]. Кальретикулин, локализованный вне ЭР, также выполняет многочисленные функции. Он участвует в процессах миграции, фагоцитоза и фиброгенеза. Местное применение кальретикулина улучшает заживление кожных ран на животных моделях. В ранах, обработанных кальретикулином, увеличивалась скорость эпителизации мигрирующими кератиноцитами и наблюдалась значительная индукция грануляционной ткани (неодермиса), синтезируемой фибробластами. Нанесение кальретикулина на рану способствует миграции моноцитов и макрофагов к месту поражения, стимулирует экспрессию интегринов (рецепторов фибронектина) кератиноцитами и фибробластами.
Белки VEGF и VEGFR относятся к сосудистым биомаркерам. VEGF (Vascular endothelial growth factor) – сигнальный белок, вырабатываемый клетками для стимуляции васкулогенеза (образования эмбриональной сосудистой системы) и ангиогенеза (роста новых сосудов в уже существующей сосудистой системе). В настоящее время известно несколько различных факторов данного семейства (которое, в свою очередь, является подклассом достаточно обширного класса факторов роста). Белки VEGF и VEGFR служат частью системы, отвечающей за восстановление подачи кислорода к тканям в ситуации, когда циркуляция крови недостаточна. Основные функции этих белков – создание новых кровеносных сосудов в ходе эмбрионального развития или после травмы и обеспечение коллатерального кровообращения (создание новых сосудов при блокировании уже имеющихся).
В результате проведенного нами исследования не было установлено сколь-нибудь значительного влияния препарата «Голдгиал» на экспрессию этих факторов. Обнаруженный рост экспрессии VEGFR (примерно на 30% по сравнению с контролем) (см. рис. 5) может быть объяснен наличием в нем некоторого количества низкомолекулярной гиалуроновой кислоты, которая также может стимулировать ангиогенез [1]. Эти белки вполне могут соответствовать критериям биомаркеров старения, так как хронические нарушения микрокапилляров – один из признаков старения дермы.
НАУЧНЫЕ ИССЛЕДОВАНИЯ
Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019 285

НАУЧНЫЕ ИССЛЕДОВАНИЯ
Сегодня считается, что большой вклад в процессы старения вносят эпигенетические факторы [16]. Наиболее изученный молекулярный механизм, «используемый» эпигенетикой, – локальная модификация молекулы ДНК с помощью реакции метилирования, то есть добавления метильной (-СН3) группы к основанию цитозину. Доставку метильной группы осуществляют ферменты-метилтрансферазы. Этот процесс можно развернуть с помощью диметилирования, происходящего либо спонтанно, либо с помощью ферментов-диметилаз. Белки семейства сиртуинов – это белки, обладающие деацителазной активностью. Сиртуины обнаружены у многих живых организмов, от бактерий до млекопитающих,
ивовлечены в регуляцию важных клеточных процессов и метаболических путей: процессов старения, транскрипции, апоптоза и сопротивляемости стрессу. По влиянию на процессы старения наиболее изучен такой представитель семейства сиртуинов, как Sirt1 [3]. В стареющих клетках экспрессия этого белка снижается, что позволяет использовать его в качестве основного эпигенетического биомаркера старения. Почти 1,5-кратный рост экспрессии Sirt1 в образце кожи №1 (с введенным препаратом «Голдгиал») – результат, который указывает на значительное торможение процессов старения кожи под воздействием наночастиц золота.
Нарушение гомеостаза коллагенового матрикса – отличительная характеристика стареющей кожи. Важную роль здесь играет молекулярный механизм активации в фибробластах транскрипционного фактора АР-1 (транскрипционного комплекса, включающего белки c-fos- и c-jun-семейств). Фактор АР-1 активирует, в частности, экспрессию генов, кодирующих специфические ферменты, – металлопротеиназы ММР-1
иММР-3 [17], что стимулирует деградацию (фрагментацию) матриксных фибрилл коллагена дермы [18]. Активация АР-1 сопровождается снижением синтеза проколлагенов I и III типов. Происходит это за
счет блокировки трансформирующего фактора роста TGF-β(способствующего биосинтезу коллагена) вследствие снижения экспрессии TGF-β/Smad-сигнального пути и его мишени – соединительнотканного фактора роста CTGF/CCN2, представляющего собой физиологический регулятор экспрессии коллагена [19, 20]. Известно, что индуцированный фотостарением рост активности АР-1 приводит к уменьшению синтеза коллагена [2]. Обнаруженное в настоящем исследовании 4-кратное снижение количества транскрипционного фактора АР-1, связанное с действием препарата «Голдгиал», притом что чистая гиалуроновая кислота в виде препарата «Контургель-ХПМ» практически не влияет на уровень экспрессии этого белка (см. рис. 6),
представляет яркое свидетельство участия наночастиц золота в замедлении процессов старения.
4 ЗАКЛЮЧЕНИЕ
Проведенные исследования наглядно свидетельствуют о реальной возможности влиять на протекание процессов старения кожи инъекционным введением в нее гидрогелевых материалов, содержащих гиалуроновую кислоту. Это влияние, вполне вероятно, может приводить к значительной отсрочке возникновения возрастзависимых признаков старения кожных покровов. Причем присутствие некоторых биоактивных компонентов, в нашем случае наночастиц золота, в разы увеличивает эффективность омолаживающего действия. Нечто подобное мы наблюдали при действии цинксодержащих препаратов гиалуроновой кислоты [21]. Наши исследования еще только начались, но уже сейчас можно говорить о создании некой платформы биомаркеров старения дермы, которая позволит научно оценивать эффективность воздействия на кожу тех или иных материалов. Очевидно, что достаточно трудно выбрать какой-либо один биомаркер старения, который удовлетворял бы всем необходимым критериям научной оценки, так как каждый из них имеет как свои преимущества, так и свои ограничения [3]. Поэтому поиск новых биомаркеров собственно старения и маркеров, ассоциированных с протеканием связанных со старением процессов, – задача чрезвычайно актуальная для различных областей современной медицины.
ЛИТЕРАТУРА
1.Хабаров ВН. Гиалуроновая кислота в инъекционной косметологии. – М.: ГЭОТАР-МЕД, 2017.
2.Хабаров ВН. Коллаген в косметической дерматологии. – М.: ГЭОТАР-МЕД, 2018.
3.Фоменко А, Баранова А, Митницкий А и др. Биомаркеры старения человека. – СПб.: Европейский дом, 2016.
4.Fonseca FL, da Costa AAB, Azzalis LA, et al. Matrix Metalloproteases as Biomarkers of Disease. Methods Mol Biol, 2017;1579:299.
5.Phillips TM, Fadia M, Lea-Henry TN, et al. MMP2 and MMP9 associate with crescentic glomerulonephritis. Clin Kidney J, 2017;10(2):215–220.
6.Juchniewicz A, Kowalczuk O, Milewski R, et al. MMP10, MMP-7, TIMP-1 and TIMP-2 mRNA expression in esophageal cancer. Acta Biochim Pol, 2017, May 15.
7.Рогова ЛН, Шестернина НВ, Замечник ТВ и др. Матриксные металлопротеиназы, их роль в
286 Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019

физиологических и патологических процессах. Вестн нов мед технол, 2011;(4):86–89.
8.Смирнова ИО, Кветной ИМ, Князькин ИВ и др. Нейроиммуноэндокринология кожи и молекулярные маркеры ее старения. – СПб.: ДЕАН, 2005.
9.Хабаров ВН, Бойков ПЯ. Биохимия гиалуроновой кислоты. – М.: Тисо-принт, 2016.
10.Nigdelioglu R, Hamanaka RB, Meliton AY, et al. TGF-β Promotes de novo Serine Synthesis for Collagen Production. J Biol Chem, 2016, Nov 11, pii: jbc. M116.756247.
11.Kuro-o M, Matsumura Y, Aizawa H, et al. Mutation of the mouse klotho gene leads to a syndrome resembling ageing. Nature, 1997;390(6655):45–51.
12.Kurusu H, Yamamoto M, Clark JD, et al. Suppression of aging in mice by hormone Klotho. Science. 2005;309(5742):1829–33.
13.Li Y, He X, Olauson H, Larsson TE, et al. FGF23 affects the lineage fate determination of mesenchymal stem cells. Calcif Tissue Int, 2013;93(6):556–64.
14.Bian A, Neyra J.A, Zhan M, et al. Klotho, stem cells, and aging. Clin Interv Aging, 2015;10:1233–43.
15.Jung T, H hn A, Catalgol B, et al. Age-related differences in oxidative protein-damage in young and senescent fibroblasts. Arch Biochem Biophys, 2009;483(1):127–35.
16.Jones MJ, Goodman SJ, Kobor MS. DNA methylation and healthy human aging. Aging Cell. 2015;14(6):924–32.
17.Stephens P, Genever P. Non-epithelial oral mucosal progenitor cell populations. Oral Diseases, 2007;13:1–10.
18.Kohl E, Steinbauer J, Landthaler M, et al. Skin ageing. J Eur Acad Dermatol Venereol (JEADV), 2011;25(8):873–884.
19.Fisher G.J, Shao Y, He T, et al. Reduction of fibroblast size/mechanical force down-regulates TGF-β type II receptor: implications for human skin aging. Aging Cell, 2016;15(1):67–76.
20.Fisher G, Kang S, Varani J. Mechanism of photoaging and chronological skin aging. Arch Dermatol, 2002;138:1462–67.
21.Хабаров ВН, Жукова ИК, Кветной ИМ. Оценка эффективности применения в инъекционной косметологии цинксодержащих препаратов методом иммунофлуоресцентного анализа. Эстетическая медицина, 2019;ХVII(2):153–158.
НАУЧНЫЕ ИССЛЕДОВАНИЯ
РЕКЛАМА
Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019 287

НАУЧНЫЕ ИССЛЕДОВАНИЯ
Кожа как иммунный орган
1 ВВЕДЕНИЕ
Главная задача нашей кожи – быть границей, которая отделяет свое и чужое. Несмотря на то что ее постоянно атакуют патогены на площади почти 2 м2, у кожных покровов имеются эффективные механизмы защиты, которые помогают им быстро избавляться от вторжения и, что важно, на самом раннем этапе. Анатомии этих защитных барьеров и будет посвящена данная статья.
2ИММУННАЯ СИСТЕМА КОЖИ: ОПРЕДЕЛЕНИЯ
Вкожных покровах выявлено большое количество клеток лимфоидного ряда, что позволило ввести термин «лимфоидная ткань, ассоциированная с кожей», или SALT (Skin Associated Lymphoid Tissue), по аналогии с такими же образованиями в пищеварительной, дыхательной и мочеполовой системах. Под термином SALT подразумевают регионарные лимфатические узлы и мигрирующие в них клетки лимфоидного ряда, которые осуществляют функцию иммунологического надзора в строго определенном регионе (об особенностях лимфодренажа и топографии лимфатических узлов головы и шеи см. нашу статью в журнале «Эстетическая медицина», 2019;XVII(2)).
Е. Иванова, кандидат медицинских наук, доцент кафедры морфологии медико-биологического факультета РНИМУ им. Н.И. Пирогова, Москва
Известно, что помимо лимфоцитов, которые относятся к системе адаптивного иммунитета, в коже содержится большое количество факторов врожденной защиты гуморальной и клеточной природы, поэтому сейчас принято более широкое понятие –
иммунная система кожи, или SIS (Skin Immune System) [1].
У кожных покровов можно выделить три уровня защиты, разные по природе. Их факторы включаются на борьбу с патогеном не одномоментно, а дополняя друг друга в случае несостоятельности предшественников.
Первый барьер – неспецифический – неповрежденная кожа, второй – факторы врожденного иммунитета, которые включаются на самых ранних этапах проникновения антигена, практически мгновенно, третий – факторы адаптивного иммунитета, которые наиболее точны в элиминации данного антигена (для формирования их de novo требуется около 7 дней). Важно подчеркнуть, что особенность кожи как иммунного органа – преобладание врожденного иммунитета над адаптивным [1, 2].
3ПЕРВЫЙ БАРЬЕР – НЕСПЕЦИФИЧЕСКИЙ – НЕПОВРЕЖДЕННАЯ КОЖА
Кнему относятся «механические» факторы.
Во-первых, это многослойный эпителий с
поверхностным ороговевающим слоем (рис. 1а). Во-вторых, нормальная микрофлора, которая
помогает сохранять биологическую стабильность, кроме того, выделяемые ею антимикробные факторы защищают ее от патогенных микроорганизмов.
288 Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019

а |
б |
Устойчивость этой экосистемы к внешним воздействиям регулируется несколько сниженной кислотностью (5,2–5,7 для нормальной кожи), сравнительно прохладной температурой и пониженной влажностью, в то время как для большинства бактерий оптимальными считаются нейтральная рН, температура 33° С и высокая влажность [5]. Интересно отметить, что микрофлора лица отличается от микрофлоры других участков тела, а микрофлора в области лба и переносицы от микрофлоры других областей лица (рис. 1б). Тот факт, что слабокислая рН поверхности кожи благотворна для местного иммунитета, сегодня считается неоспоримым.
В-третьих, водно-липидная мантия (водно-жиро- вая, кислотная, мантия Маркионини) на поверхности рогового слоя кожи. В нее входят продукты деятельности придатков кожи – сальных и потовых желез, а роль эмульгаторов играют вещества, образующиеся в процессе ороговения. Водно-жировая мантия представляет собой смесь себума (кожного сала), пота, остаточных продуктов процесса кератинизации и кожной микрофлоры.
Хочется особо остановиться на роли в иммунопротекции сальных желез, которые называют «мозгом кожи». Они транспортируют жирорастворимые антиоксиданты (витамины А, Е) к поверхности рогового слоя, обеспечивают фотопротекцию, антимикробную и фунгицидную активность, терморегуляцию, удержание влаги, формирование индивидуального запаха. Считается, что сальные железы ответственны за гормонально индуцированное старение кожи, так как имеют рецепторы к половым гормонам, чувствительность к которым наследуется [6].
Первый неспецифический барьер достаточно эффективен в защите от крупных патогенов, однако оказывается недостаточно надежным в случае вирусной инфекции. Так, стало известно, что сравнительно мелкие вирусы, например вирус
Рис. 1. Кератиновые чешуйки и колонии микроорганизмов на поверхности эпителия (SEMфото) (а) [3]. Микробиота лица человека (б) [4]
иммунодефицита человека, могут проникать через неповрежденную кожу сквозь узкие межклеточные промежутки, образующиеся в процессе пролиферации эпителиоцитов. А отдельные виды бактерий, например возбудитель сифилиса бледная трепонема, «научились» вырабатывать ферменты, «расплавляющие» эпителиоциты, волокна базальной мембраны и элементы межклеточного матрикса дермы. Даже некоторые грибы (возбудители микозов
Trichophuton ribrum, Trichophuton mentagraphytes) способны расщеплять кератин и преодолевать роговой барьер [1].
4ВТОРОЙ БАРЬЕР – ВРОЖДЕННЫЙ ИММУНИТЕТ КОЖИ
Его составляют факторы, относящиеся к врожденному иммунитету кожи. Их подразделяют на клеточные и гуморальные. Последние функционируют преимущественно в поверхностных слоях кожных покровов, первые – локализуются глубже. Клеточные факторы подключаются только в том случае, если патоген преодолел неспецифический защитный барьер и не был нейтрализован гуморальными факторами. Особенность врожденного иммунитета кожи – в преобладании клеточных факторов над гуморальными [1].
А.Клеточные факторы врожденного иммунитета
Общими в деятельности клеток, относящихся к врожденной защите, считается их способность осуществлять типовое распознавание антигенов, так называемых «молекулярных шаблонов», например
НАУЧНЫЕ ИССЛЕДОВАНИЯ
Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019 289

НАУЧНЫЕ ИССЛЕДОВАНИЯ
липополисахаридов клеточной стенки. Далее происходят фагоцитоз, процессинг и выставление на мембране фрагмента антигена – его «визитной карточки» [7]. Выделение такой «визитной карточки» – очень важный момент! Если расщепление патогена произойдет некачественно и будет определен нерепрезентативный иммуногенный пептид, все дальнейшие действия против конкретного патогена станут неэффективны.
К клеточным факторам неспецифического врожденного иммунитета относят следующие гистотипы клеток: разновидности моноцитов (клетки Лангерганса, дермальные дендроциты, кожные макрофаги), особые популяции оседлых лимфоцитов (резидентные кожные лимфоциты, натуральные киллеры, или NK-клетки), клетки, входящие в состав кожных покровов (меланоциты, кератиноциты, эндотелиоциты сосудов кожи), и клетки белой крови миелобластного происхождения (тучные клетки, нейтрофилы и эозинофилы) [7, 8]. Важно помнить, что у нижеописанных клеток сходных гистотипов будут сходные функции и механизмы защиты.
Клетки Лангерганса – внутриэпидермальные дендритные клетки, или белые отростчатые эпидермоциты, – это клетки макрофагального происхождения, представляющие собой разновидность дендритных клеток, которые составляют от 2 до 5% от клеточной популяции [8]. Названы в честь Пауля Лангерганса, впервые описавшего их в 1868 году [9]. Клетки Лангерганса концентрируются в базальном и шиповатом слоях эпидермиса (рис. 2а). Их отличительная особенность – присутствие в цитоплазме похожих на теннисные ракетки органелл Бирбека, в которых содержится белок лангерин, способствующий нейтрализации вирусов [10] (рис. 2б). Отростки клеток Лангерганса – псевдоподии – переплетаются с соседними клетками, создавая в эпидермальном слое защитную сеть-
а |
б |
«кольчугу» [6] (рис. 2в). При этом псевдоподии данных клеток расположены практически на поверхности кожи и доступны для обработки косметическими средствами с иммуномодуляторами.
Дермальные дендроциты – клетки моноцитарного происхождения, которые располагаются глубже вышеописанных клеток Лангерганса. Основная их задача – представлять (презентовать) антиген другим клеткам. Могут активизировать иммунитет de novo, привлекая так называемые «наивные» лимфоциты, которые еще не встречались с антигеном. Способствуют сохранению иммунологической толерантности к собственным антигенам кожи, которые высвобождаются при травме и воспалении. Осуществляют профилактику аллергических реакций за счет нейтрализации аллергенов, что не допускает контакта последних с тучными клетками, к тому же содержат рецепторы к Fc-фрагментам иммуноглобулинов класса E (IgE) и осуществляют фагоцитоз иммунных комплексов, в состав которых входят IgE [14].
Макрофаги кожи, они же гистиоциты, – клетки моноцитарного происхождения, осуществляющие фагоцитоз и презентацию антигена. Могут разрушать крупные патогены, например инородные тела или внутрикожных гельминтов (рис. 3). Удаляют тканевой дендрит из зоны повреждения, продуцируют ростовые факторы, способствуют заживлению ран. Могут трансформироваться в клетки Лангерганса для восполнения дефектов в защитной дендритической сети. Гистиоциты – связующее звено между воспалением и регенерацией, их активация индуцирует пролиферацию клеток эпидермиса [14].
При дефектах фагоцитарной активности гистиоцитов кожа становится чувствительной ко многим бактериальным и грибковым инфекциям. При этом нарушаются процессы антигенной презентации и потому снижается эффективность
в
Рис. 2. Клетки Лангерганса (черные) в шиповатом и базальном слоях эпидермиса. Окраска метиленовым синим (а) [11]. Органеллы Бирбека. Электронограмма (б) [12]. Сетка, образованная отростками клеток Лангерганса. SEM-фото (в) [13]
290 Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019
