
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / МЕХАНИЗМЫ_ВЛИЯНИЯ_ИНДУЦИРУЕМОЙ_АЦЕТИЛХОЛИНЭСТЕРАЗОЙ_ОЛИГОМЕРИЗАЦИИ
.pdf81
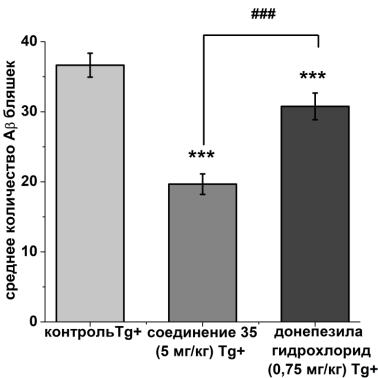
3.14 Исследование количества β-амилоидных депозитов после отмены терапии соединением 35
После окончания поведенческого теста в Т-лабиринте, проведенного после отмены ведения препаратов, нами было проанализировано количество β-
амилоидных бляшек. На момент окончания поведенческого теста, в контрольной группе APP/PS1 (Tg+) мышей количество β-амилоидных отложений составляло
36,64±1,71, а в группе трансгенных мышей, получавших донепезила гидрохлорид
30,76±1,9 (p<0,001), что только на 16% меньше по сравнению с контрольной группой трансгенных животных. В группе трансгенных мышей, получавших соединение 35, количество β-амилоидных бляшек составило 19,66±1,46 (p<0,001),
что на 46% ниже, чем в контроле. При этом наблюдались достоверно значимые отличия и между группами, получавшими донепезила гидрохлорид и соединение
35 (p<0,001; Рисунок 18).
Таким образом, можно заключить, что соединение 35 в условиях данной модели БА способно оказывать намного более выраженный модифицирующий заболевание эффект чем донепезил гидрохлорид, что выражается в улучшении пространственной памяти и сопровождается более выраженным снижением количества амилоидных депозитов.
Данные эксперименты с блокатором индуцируемой АХЭ олигомеризации β-
амилоидного пептида могут быть интерпретированы и с точки зрения анализа вклада данного процесса в формирование нарушений пространственной памяти у мышей с БА. Можно утверждать, что индуцируемая АХЭ олигомеризация β-
амилоида (частично устраняемая соединением 35), вносит вклад в формирование нарушений памяти в условиях генетической модели БА на мышах. Механизмом,
опосредующим этот отрицательный эффект АХЭ на пространственную память, в
данной модели БА, вероятно, является усиление синаптической дисфункции из-за увеличения количества амилоидных бляшек и связанного с этим увеличения локальной концентрации растворимого олигомеризованного β-амилоидного пептида.
t.me/medicina_free
82
Рисунок 18 – количество β-амилоидных бляшек в поле зрения в энторинальной коре головного мозга трансгенных APP/PS1 (Tg+) после отмены терапии препаратами.
Показано среднее количество β-амилоидных бляшек (в поле зрения,
увеличение x10) в энторинальной коре головного мозга трансгенных APP/PS1
(Tg+) мышей контрольной группы и групп, получавших соединение 35 (5 мг/кг) и
донепезила гидрохлорид (0,75 мг/кг) после отмены терапии. Данные представлены как средние значения ± SEM. ***-различие с контрольной группой трансгенных мышей статистически достоверно при p≤0,001; ###-различие c
группой трансгенных мышей, получавших донепезила гидрохлорид статистически достоверно при p≤0,001. Статистический анализ проведен с
помощью теста Манна-Уитни.
t.me/medicina_free
83
ГЛАВА 4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
Первой гипотезой, позволяющей обяснить основную часть симптомов БА на ранних стадиях данного заболевания и, соответственно, позволившей предложить способ симптоматической терапии стала, выдвинутая в 70-х годах 20-
го века, «холинергическая гипотеза». В это время было обнаружено, что для ранних стадий БА характерна дегенерация холинергических нейронов переднего мозга пациентов, что, в том числе, ведет к снижению холинергической иннервации гиппокампа и представляет собой ключевой фактор, приводящий к нарушениям формирования памяти (Bartus et al., 1982; Rylett et al.,1983; Nilsson et al., 1986; Bowen et al., 1982). Несмотря на то, что «избирательное» влияние на холинергические нейроны на ранних стадиях БА описано достаточно давно, в
литературе фактически отсутствуют гипотезы, позволяющие высказать предположения о механизмах, опосредующих гибель именно нейронов,
секретирующих АХ.
Второй гипотезой, позволяющей объяснить причину гибели нейронов, не только холинергических, стала выдвинутая в 90-х годах 20-го века, «амилоидная гипотеза» БА. Данная гипотеза предполагает, что к нейротоксичности приводит избыточное продуцирование, или снижение клиренса токсичных олигомеризованных форм β-амилоида. Данный пептид (преимущественно его мономерный фрагмент Aβ1-42), в пикомолярных концентрациях присутствует в мозге здоровых людей, где принимает участие в регуляции синаптической активности (Shoji, 2002; Cirrito et al., 2005; Abramov et al., 2009; Giuffrida et al.,
2009; Morley et al., 2010). Однако, известно, что при определенных условиях,
мономеры β-амилоида способны олигомеризоваться в фибриллы, обладающие токсическим эффектом в отношении клеток мозга (Klein, 2001).
Многочисленные лабораторные исследования, проведенные в последнее десятилетие, показали, что именно растворимые олигомеры β-амилоида ухудшают как синаптическую функцию, так и синаптическую структуру (Walsh, 2007, Wang et al., 2002). В частности, было показано, что растворимые олигомеры
t.me/medicina_free
84
Aβ42, выделенные непосредственно из коры больных БА, могут доза-зависимо уменьшать количество синапсов, влиять на их функциональные характеристики и ухудшать память у здоровых взрослых крыс (Shankar et al, 2008).
Есть основания полагать, что амилоидные бляшки также способны ухудшать память за счет того, что являются местами наибольшей локальной концентрации токсичных олигомеров β-амилоида. Так в мозге животных с моделью БА, наибольшая концентрация растворимого β-амилоида была обнаружена именно вблизи амилоидных бляшек. Оказалось, что каждая амилоидная бляшка окружена «облаком» растворимых олигомеров β-амилоида в концентрации, которая значительно превышает среднюю концентрацию пептида в головном мозге трансгенных животных (Koffi et al., 2009). Важно отметить, что уменьшение числа синаптических контактов между нейронами происходит только в районе бляшек, причем в области «облака» растворимого Aβ,
окружающего ядро бляшки, гибнет 60% синаптических контактов (Koffi et al., 2009). Кроме того, было показано, что в области бляшек наблюдается выраженное изменение активности нейронов, такое как увеличение числа «молчащих» и «гиперактивных» нейронов (Busche et al., 2012). Также было показано, что дендриты, проходящие через амилоидные бляшки или вблизи них, подвергаются потере шипиков и атрофии как у мышей с БА (Tsai et al., 2004), так и у пациентов
(Cras et al., 1991).
Внастоящее время взаимосвязь между двумя гипотезами БА
(холинергической и амилоидной) установлена не достаточно четко. Так, с одной стороны, показано, что внутриклеточный β-амилоид селективно накапливается в холинергических нейронах переднего мозга людей начиная со среднего возраста,
причем в позднем возрасте в нейронах переднего мозга преобладают токсичные олигомеризованные формы β-амилоида (Dickson and Murray, 2015). Кроме того,
на культурах нейронов, а также с использованием нескольких генетических моделей БА на мышах, показано, что синаптические контакты, образуемые именно холинергическими нейронами более чувствительны к токсическим эффектам β-амилоида, по сравнению с синапсами глутаматергических или
t.me/medicina_free
85
ГАМКергических нейронов: показано снижение иммуноэкспрессии везикулярного транспотера ацетилхолина и увеличение количества холинергических дистрофических нейритов, окружающих β-амилоид у трансгенных APP/PS1 мышей (Hu et al., 2003).
Таким образом, можно предположить, что причиной «избирательной» гибели холинергических нейронов на ранней стадии БА является олигомеризованный β-амилоид. С другой стороны, о конкретных механизмах,
опосредующих селективное токсическое действие β-амилоида именно на холинергическую систему головного мозга фактически ничего не известно.
В этой связи представляется важным, что АХЭ, которая является неотъемлемым компонентом любого холинергического синапса, была обнаружена в составе β-амилоидных бляшек в мозге пациентов с БА (Giaсobini 2003).
Исследования in vitro показали, что АХЭ ускоряет олигомеризацию β-амилоида
(Inestrosa et al., 1996). При этом β-амилоид взаимодействует с АХЭ в области ее ПАС, образуя комплекс, отличающийся повышенной токсичностью (Munoz and Inestrosa, 1999). Взаимосвязь АХЭ-β-амилоид также подтверждается исследованиями на двойных трансгенных мышах, экспрессирующих как человеческую АХЭ, так и APPswe: показан более высокий уровень образования бляшек у этих животных по сравнению с трансгенными мышами,
экспрессирующими только APPswe (Rees et al., 2003, 2005). У пациентов с БА наблюдалается накопление растворимых комплексов АХЭ-β-амилоид в спинномозговой жидкости (Darreh-Shori et al., 2012, 2014). Кроме того, данное взаимодействие АХЭ-β-амилоид, вызывает сильное ингибирование активности АХЭ, выделяемой из спинномозговой жидкости пациентов с БА (Darreh-Shori et al., 2014). Кроме того, интересно отметить, что синаптическая АХЭ локализуется в липидных плотиках, способствующих образованию β-амилоида и облегчающих его агрегацию на нейрональных мембранах (Xie et al., 2010; Hicks et al., 2011; Rushworth and Nigel, 2011).
Таким образом, можно предположить, что именно опосредуемое АХЭ усиление олигомеризации β-амилоида является по крайней мере одним из
t.me/medicina_free
86
механизмов, лежащих в основе высокой чувствительности холинергических структур мозга к β-амилоиду.
В данном исследовании нами впервые была предпринята попытка установить возможный вклад индуцируемой АХЭ олигомеризации β-амилоида в развитие нарушений памяти в условиях модели БА на животных.
Исследование состояло из двух этапов. Первый этап заключался в изучении влияния олигомеризированного β-амилоида на синаптические контакты в головном мозге мышей, оверэкспрессирующих мутантные человеческие APP/PS1.
Важно отметить, что потеря синапсов является одним из важных компонентов патогенеза БА. При этом известно, что нарушение пространственной памяти, известное как ранний клинический признак БА, обусловлено в первую дегенерацией холинергической синаптической передачи, а не гибелью нейронов
(Ittner et al., 2010; Price et al.,1998; Zhu, 2017).
Оценив изменение уровня иммуноэкспрессии синаптофизина в районе β-
амилоидных бляшек, мы показали, что его локальное снижение говорит о прямом токсическом воздействии олигомеризированных форм β-амилоида на синаптические контакты. Изменение уровня иммуноэкспрессии синаптофизина было использовано в качестве маркера патологических изменений на втором этапе исследований, где с помощью подобранного блокатора ПАС АХЭ и была доказана гипотеза о вкладе индуцируемой АХЭ олигомеризации β-амилоида в формирование нарушений памяти.
В исследовании мы связали снижение синаптических контактов с нарушениями памяти через образование β-амилоидных бляшек. Применив блокатор ПАС АХЭ (соединение 35) и снизив с его помощью индуцируемую АХЭ олигомеризацию β-амилоида, мы уменьшили токсический эффект β-амилоида в отношении синаптических контактов. Кроме того, было показано, что предотвращение связывания АХЭ с β-амилоидным пептидом замедляет развитие нарушений памяти у трансгенных мышей.
Впервые для ингибиторов АХЭ, связывающихся в районе ПАС был применен специализированный тест: дизайн экспериментов в работе был
t.me/medicina_free
87
разработан таким образом, чтобы отделить временный симптоматический эффект блокаторов ПАС АХЭ, связанный с увеличением времени жизни АX в головном мозге, от эффекта, модифицирующего заболевание: были проведены эксперименты с «отменой терапии».
Мы обнаружили, что соединение 35 вызывает увеличение содержания растворимого фрагмента Aβ1-40. Скорее всего, это связано с конкуренцией β-
амилоида с ПАС АХЭ. При этом соединение 35 не влияет на концентрацию более токсичного фрагмента Aβ1-42. Затем мы показали, что лечение соединением 35 и
донепезила гидрохлоридом оказывает положительное влияние на состояние синаптических контактов, оцениваемое с помощью интенсивности иммуноэкспресии синаптофизина. Это предполагает, что ингибитор АХЭ,
который мы использовали в этом исследовании, не вызывает катастрофического увеличения содержания токсичных олигомеров β-амилоида, приводящих к гибели синапсов. Мы также показали, что после отмены терапии соединением 35 у
мышей сохранялась лучшая способность к обучению в Т-образном лабиринте, в
отличие от животных, не получавших лечения или получавших донепезила гидрохлорид.
Эти данные дают основания утверждать, что индуцируемая АХЭ олигомеризайия β-амилоида, по крайней мере в условиях модели БА, вносит вклад в патогенез данного заболевания.
В этой связи, важно отметить, что согласно современным представлениям олигомеризованный β-амилоид распространяется по структурам головного мозга больных БА не случайным образом, а беря начало из неких «очагов распространения». Так, было показано, что внутрицеребральная инъекция олигомеризованного β-амилоида, полученного из головного мозга старых Tg2576
мышей, значительно ускоряет отложение β-амилоида у молодых мышей той же трансгенной линии (Eisele et al., 2010; Stöhr et al., 2012; Morales et al., 2015).
Важно отметить, что даже небольшое количество компетентного к олигомеризации β-амилоида может инициировать отложение паннейронального токсичного β-амилоида с по всему мозгу (Sowade and Jahn, 2017). Таким образом,
t.me/medicina_free
88
локальное перепроизводство склонного к олигомеризации β-амилоида может объяснить очаговое инициирование каскада, который впоследствии вызывает широкую патологию. Учитывая тот факт, что именно нарушение холинергической нейротрансмиссии является хорошо известным признаком начала БА, результаты данного исследования поднимают вопрос о том, что процесс индуцируемой АХЭ олигомеризации β-амилоида возможно не просто вносит вклад в патогенез. На данный момент мало известно о том, какие условия необходимы для образования начального «очага» олигомеризации β-амилоида.
Результы данного исследования позволяют высказать обоснованное предположение о том, что в холинергических синапсах индуцируемая АХЭ олигомеризация β-амилоида, возможно, является одним из факторов, собственно и запускающих патологические изменения на начальной стадии БА.
Нельзя исключать влияние и других механизмов нейропротекции во время терапии соединением 35. В частности, благодаря увеличению продолжительности жизни АХ ингибиторы АХЭ могут дополнительно активировать рецепторы ацетилхолина. Действительно, активация мускариновых рецепторов может регулировать процессинг БПА (Nitsch et al., 1992), а никотиновые рецепторы могут играть важную роль в нейропротекции (Medeiros et al., 2013). Кроме того,
нельзя исключать и эффекты активации не нейрональных холинорецепторов. Так,
известно, что β-амилоидные бляшки окружены активированной микроглией и реактивными астроцитами, перепроизводящими воспалительные цитокины,
которые, в свою очередь, способствуют образованию β-амилоида (Akiyama et al., 2000). При этом АХ способен связываться с рецепторами на астроцитах и микроглии, уменьшая провоспалительные цитокины, а также увеличивая высвобождение факторов роста (Maurer and Williams, 2017). Однако, данные механизмы нейропротекции описаны и для традиционных ингибиторов АХЭ.
Поэтому преимущество соединения 35 мы связываем именно с увеличением влияния соединения 35 на индуцированную АХЭ олигомеризацию β-амилоида.
Помимо аспекта, связанного с тем фактом, что проведенное исследование расширяет наши знания о патогенезе БА, результаты данной работы могут
t.me/medicina_free
89
представлять интерес и с точки зрения разработки подходов к увеличению эффективности терапии БА.
Всемирная Организация Здравоохранения расценивает БА как одну из главных причин инвалидизации у людей старческого возраста, однако лекарственные средства, оказывающие значимое влияние на патогенез заболевания на момент написания данной диссертационной работы не известны
(March and Alifragis, 2018; Oxford et al., 2020). В настоящее время основу терапии БА составляет применение ингибиторов АХЭ и БуХЭ. Так, для терапии когнитивных нарушений при БА в большинстве стран разрешены четыре препарата: а) галантамина гидробромид - «Реминил» (избирательно ингибирует АХЭ); б) донепезила гидрохлорид - «Арисепт» (избирательно ингибирует АХЭ);
в) ривастигмина тартрат - «Экселон» (равноэффективно ингибирует АХЭ и БуХЭ); г) мемантина гидрохлорид – «Мемантин». «Мемантин» относится к антагонистам НМДА-рецепторов, частичная блокада которых снижает эксайтотоксичность, увеличивая тем самым выживаемость нейронов в головном мозгу пациентов с БА (Schneider et al., 2014).
В контексте данной работы важно отметить, что ингибиторы холинэстераз на данный момент являются единственной группой лекарственных средств,
отвечающих потребностям клинической практики, то есть способными оказывать клинически значимый терапевтический эффект при удовлетворительном уровне побочного действия. Мемантин обычно включают в схему терапии БА в качестве вспомогательного средства совместно с одним из вышеупомянутых ингибиторов холинэстераз.
Результаты данной работы дают основания утверждать, что экранирование ПАС АХЭ от связывания с β-амилоидом может быть весьма полезным для повышения эффективности терапии дефицита памяти при БА с помощью ингибиторов АХЭ.
Очевидной задачей, стоящей перед создателями новых конкурентоспособных ингибиторов ХЭ является получение препаратов, более эффективных, чем донепезил, ривастигмин и галантамин. Десятки клинических
t.me/medicina_free
90
испытаний показали, что эти препараты действительно снижают степень когнитивных, функциональных и поведенческих нарушений при БА, являются относительно безопасными и хорошо переносятся. Однако, как уже упоминалось,
в среднем, защита когнитивных функций этими ингибиторами холинэстераз длится не более шести месяцев (Selkoe, 2002). Таким образом, создание препарата, расширяющего это терапевтическое временное окно, может обеспечить ему конкурентное преимущество перед ингибиторами холинэстераз,
которые в настоящее время используются. Основываясь на результатах этого исследования, мы предлагаем, что экранирование ПАС АХЭ способно не только компенсировать холинергический дефицит, но и в какой-то степени замедлить прогрессирование симптомов БА. Последнее утверждение требует экспериментальной проверки на животных с БА с использованием ингибиторов АХЭ различного строения, оккупирующих различные части ПАС. К сожалению,
арсенал ингибиторов АХЭ, связывающихся с ПАС, эффективность которых была проверена на модели БА, ограничен несколькими соединениями (Viayna et al.,
2014; Zueva et al., 2019). Результаты данного исследования поднимают вопрос о целесообразности направленного синтеза новых соединений, связывающихся с АХЭ в области ПАС, а также разработки и валидации специализированных протоколов экспериментов, позволяющих оценивать влияние кандидатов в лекарственные средства на патогенез БА.
t.me/medicina_free
