
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / Эффекты_трансплантации_мононуклеарных_клеток_пуповинной_крови_человека
.pdf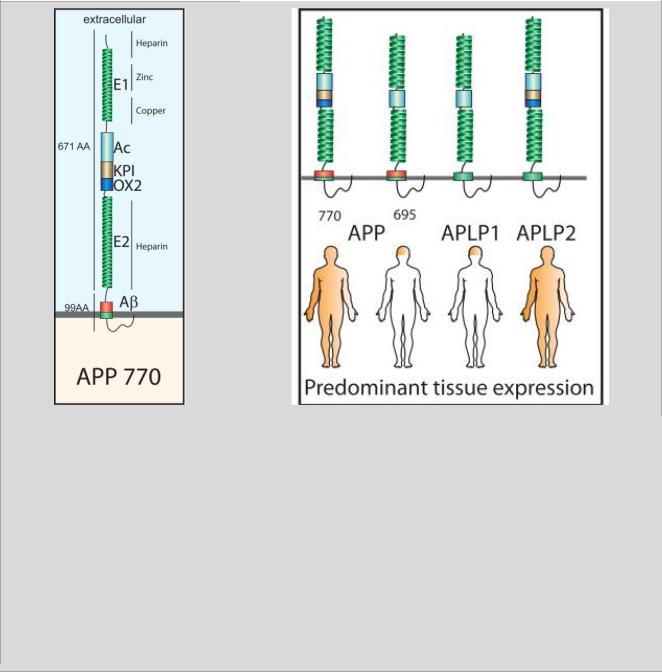
21
ткань, печень, селезенка, кожа, и кишечник [Puig et al., 2013; Tang et al., 2003].
Сплайсинговые варианты лейкоцитарного APP (L-APP: APP677, APP696, APP733,
APP752) в изобилии экспрессируется в лейкоцитах; также их экспрессия может повышаться в активированных астроцитах и микроглии [Beyreuther et al., 1993].
Рисунок 4. Доменная организация и тканевая экспрессия белков семейства APP. Слева схематическая диаграмма, изображающая доменную организацию самой длинной изоформы APP - APP770. Вверху справа схематическое изображение основных доменов у членов семейства белков АРР: двух основных вариантов сплайсинга АРР (APP695 и APP770), APLP1 и APLP2. Все члены семейства APP имеют консервативные внеклеточные домены E1 и E2 и кислотные домены - Ac. Домен E1 может связывать гепарин, цинк и медь; домен Е2 - гепарин. Некоторые изоформы APP и APLP2 содержат домен ингибитора протеазы типа Кунитц - KPI (Kunitz-type protease inhibitor domain) и ОХ2-домены. Область Aβ находится исключительно в молекуле APP. Все члены семейства APP имеют короткий высококонсервативный внутриклеточный домен. Преобладающий профиль тканевой экспрессии этих белков показан ниже [van der Kant et al., 2015].
Впервые APP был описан как рецептор клеточной поверхности [Kang et al., 1987]. Впоследствии появились свидетельства о том, что APP является также одной из молекул клеточной адгезии и вовлечен в такие процессы нейронального
t.me/medicina_free
22
развития, как миграция клеток [Valiente et al., 2010], рост и направление роста нейритов [Lowery et al., 2009], синаптогенез [Wang et al., 2009].
APP выполняет функции молекулы клеточной адгезии как во внеклеточном,
так и в цитоплазматическом доменах. Внеклеточный домен способен к самодимеризации и связыванию с некоторыми белками внеклеточного матрикса,
такими как ламинин, коллаген, спондин, гепаринсульфат, глипикан и рилин [Muller et al., 2017; Soba et al., 2005]. Цитоплазматический домен взаимодействует со связанными с цитоскелетом скаффолд-белками [van der Kant et al., 2015]. Эти признаки указывают на способность белка-предшественника амилоида механически связывать внеклеточную среду с цитоскелетом через скаффолд-белки,
аналогично другим адгезивным белкам, таким как кадгерины, интегрины β1 и L1.
Однако в отличие от кадгеринов, которые формируют соединения для плотного удержания клеток, APP обеспечивает динамическую организацию сцеплений. APP
в изобилии экспрессируется в развивающейся коре, начиная с раннего эмбрионального периода, когда происходит активная дифференцировка и миграция корковых нейронов [Young-Pearse et al., 2007], а также в подвижных частях нейронов: на дендритных шипиках и на переднем периферическом крае конуса роста аксонов [Lowery et al., 2009; Sabo et al., 2003]. Взаимодействуя с различными компонентами внеклеточного матрикса и передавая сигналы через скаффолд-белки, APP может управлять пластическим ремоделированием клеточных сцеплений. Это дает возможность аксональному конусу роста сканировать пространство в поисках подходящей цели [Lowery et al., 2009; Sabo et al., 2003].
APP играет важную роль в формировании и поддержании нервно-мышечного соединения. Кроме того, взаимодействие APP, агрина и LRP4 (англ. LDL receptorrelated protein 4) активирует мышечно-специфическую тирозинкиназу (MuSK),
запускающую кластеризацию ацетилхолиновых рецепторов [Choi et al., 2013].
APP контролирует метаболизм липопротеинов посредством взаимодействия с белками, подобными рецептору липопротеинов низкой плотности: LRP1, LRP1B, LRP2, LRP4, LRP8 (Apoer2), LRAD3; с рецепторами липопротеинов очень низкой
t.me/medicina_free

23
плотности (VLDLR), с нейрональными рецепторами аполипротеина Е (LR11), с
холестерином. Холестерин и белки, подобные рецептору липопротеинов низкой плотности, также сами могут регулировать транспортировку и процессинг APP.
Протеолитические фрагменты APP способны напрямую регулировать метаболизм холестерина. APP и его фрагменты регулируют встраивание и распределение липидов в мембране, способствуя ее реорганизации во время синаптической активности [van der Kant et al., 2015].
Примеры некоторых взаимодействий белков семейства APP и реализуемые в результате этих взаимодействий функции схематически представлены на рисунке
5.
Рисунок 5. Взаимодействия белков семейства APP и реализуемые в результате этих взаимодействий функции [Sosa et al., 2017].
t.me/medicina_free
24
Протеолитическая обработка белка-предшественника амилоида
Aβ выщепляется из трансмембранного участка белка-предшественника амилоида путем последовательного расщепления двумя протеазами: β- и γ-
секретазами. β-Секретаза (BACE1 - β-site APP cleaving enzyme 1), высвобождает растворимый внеклеточный фрагмент APP (sAPPβ) с формированием C-концевого мембранно-связанного фрагмента, известного как C99 (рис. 6А). C99 подвергается последующему внутримембранному расщеплению с помощью γ-секретазы -
многокомпонентного протеазного комплекса, включающего четыре трансмембранных белка: пресенилин, никастрин, Pen2 и Aph1 [Strooper et al., 2010].
Расщепление C99 γ-секретазой приводит к образованию Aβ и высвобождению в цитоплазму внутриклеточного домена APP (AICD). Сайт действия γ-секретазы вариабелен. В результате этого образуются пептиды Aβ в диапазоне от 34 до 50
аминокислот. Около 90% всех фрагментов Aβ - это Aβ40. Меньшая фракция представлена более склонными к олигомеризации и образованию фибрилл пептидами Aβ42 и Aβ43, обнаруживаемыми в амилоидных бляшках [Kummer et al., 2014].
АРР может подвергаться альтернативному, неамилоидогенному,
расщеплению, осуществляемому комплексом дезинтегрина и металлопротеиназы
10 (ADAM10 - A Disintegrin And Metalloproteinase domain 10), также известным как
α-секретаза. Под действием α-секретазы высвобождается растворимый эктодомен
(sAPPα) и образуется связанный с мембраной фрагмент C83 (рис. 6Б).
Последующее расщепление C83 γ-секретазой высвобождает усеченную форму Aβ,
которая не является токсичной (P3) [Muller et al., 2016].
В процессинге APP участвуют еще три протеазы. Аспарагин-эндопептидаза
(AEPasparagine endopeptidase), известная как δ-секретаза, представляет собой цистеиновую протеиназу, которая активируется при старении и связана с патогенезом БА - AEP расщепляет АРР по остаткам N373 и N585, избирательно влияя на амилоидогенную фрагментацию АРР [Zhang et al., 2015].
t.me/medicina_free
25
Мембранно-связанная металлопротеиназа (MT5-MMP, η-секретаза)
расщепляет АРР по аминокислотам 504–505, высвобождая укороченный растворимый эктодомен APP (sAPP-η). После отщепления sAPP-η С-концевой фрагмент CTF-η обрабатывается ADAM10 или BACE1 с высвобождением пептидов Aη (Aη-α или Aη-β, рис. 6В). Продуцируемые η-секретазой С-концевые фрагменты APP в большом количестве присутствуют в дистрофических нейритах как у людей с болезнью Альцгеймера, так и в мышиных моделях болезни.
Снижение экспрессии MT5-MMP облегчает амилоидную патологию,
нейровоспаление и снижение когнитивных функций у мышей с моделью БА
[Baranger et al., 2016]. Интересно отметить, что генетическое и фармакологическое ингибирование активности BACE1 приводит к устойчивому накоплению CTF-η и Aη-α. Aη-α ослабляет нейрональную активность в гиппокампе in vivo, а также снижает долговременную потенциацию на срезах гиппокампа ex vivo. Это ограничивает использование ингибиторов BACE1 для снижения образования бета-
амилоида [Willem et al., 2015].
Мелаллопротеаза семейства мепринов - меприн β – также расщепляет АРР,
причем сайт расщепления идентичен участку расщепления β-секретазы или находится в непосредственной близости от него. Затем следует расщепление С-
концевого фрагмента γ-секретазой, в результате чего происходит генерация Aβ или его укороченных вариантов, например, Aβ 2-40. [Bien et al., 2012]. Кроме того,
меприн β может разрезать APP на N-конце, высвобождая два нетоксичных N-
концевых фрагмента размером 11 и 22 кДа, а именно APP11 и APP22 [Jefferson et al., 2011].
Кроме того, в крови пациентов с болезнью Альцгеймера обнаруживаются укороченные фрагменты бета-амилоида - Aβ25-35, Aβ31-35. В нейродегенерации и образовании сенильных бляшек может принимать участие процесс рацемизации сериновых остатков в Aβ-пептиде (L-форма серина в положении 26, L-Ser26,
рацемизируется – преобразуется в D-форму, D-Ser26) [Kaneko et al., 1995]. Aβ1-40
с рацемизированным остатком Ser26 ([D-Ser26]Aβ1-40) растворим и нетоксичен
t.me/medicina_free

26
для нервных клеток, но легко превращается протеазами мозга в укороченные токсичные фрагменты [D-Ser26]Aβ25-35 и [D-Ser26]Aβ25-40 [Kubo et al., 2002].
Рисунок 6. Процессинг белка-предшественника амилоида. (A) При воздействии β-секретазы (BACE1) APP подвергается амилоидогенному пути обработки. BACE1 отщепляет от APP пептид sAPPβ. Далее γ-секретаза расщепляет оставшийся трансмембранный домен и высвобождает амилоид-β (Aβ). (Б) Неамилоидогенный путь обработки APP инициируется α- секретазой (ADAM10). В результате образуется пептид sAPPα. Последующее расщепление тансмембранного домена γ-секретазой высвобождает нетоксичную усеченную форму пептида Aβ, называемую P3. (C) APP может быть расщеплен -секретазой (MT5-MMP). Это приводит к освобождению пептида sAPP . C-концевой фрагмент (CTF- ) может разрезаться α- или β- секретазой. В результате высвобождается пептид A -α или A -β [Muller et al., 2016].
Функции протеолитических продуктов APP: sAPP
После регулируемого протеолиза sAPPα и sAPPβ высвобождаются во внеклеточную среду, где они участвуют в таких процессах, как рост клеток,
образование синапсов и рост нейритов. Фрагменты sAPPα (и sAPPβ) могут стимулировать рост нейритов через взаимодействие с рецепторами нейротрофина p75 [Hasebe et al., 2013]. Сообщалось, что sAPPα частично восстанавливает плотность шипиков в культивируемых нейронах мышей с нокаутом APP [Tyan et al., 2012]. sAPPα также действует как фактор пролиферации для эмбриональных нейрональных стволовых клеток [Hayashi et al., 1994], взрослых нейрональных
t.me/medicina_free
27
прогениторных клеток, мезенхимальных стволовых клеток, стволовых клеток париетальной оболочки плаценты человека и др. [Demars et al., 2011].
Кристаллическая структура sAPP показывает, что входящий в его состав
GFLD домен (англ. growth factor-like domain, GFLD), схож по строению с факторами роста, богатыми цистеином [Rossjohn et al., 1999]. В этом свете неудивительно, что sAPPα стимулирует пролиферацию ряда различных типов клеток [Gralle et al., 2009].
Несколько исследований сообщают, что sAPPα обладает нейропротекторной функцией. Это было показано в случаях с токсическим влиянием Aβ, при черепно-
мозговых травмах и эксайтотоксических воздействиях [Lazarov et al., 2012]. sAPP
может способствовать выживанию клеток за счет нарушения димеризации APP,
препятствуя таким образом его протеолитическому расщеплению [Gralle et al., 2009].
Функции протеолитических продуктов APP: APP C99 и C83
После расщепления APP α-секретазой или β-секретазой остается относительно небольшой трансмембранный домен с С-концевым фрагментом
(СКФ), который взаимодействует с несколькими адаптерными и сигнальными белками. Неизвестно, происходят ли эти взаимодействия исключительно с СКФ или также с полноразмерными APP или AICD. С С-концевым фрагментом APP
взаимодействуют белки, содержащие фосфотирозин-связывающий домен (FE65,
X11, Dab-1 и JIP-1) или домен SH2 (Src Homology 2). Связывание СКФ регулируется фосфорилированием. Всего было показано, что на СКФ имеется семь сайтов фосфорилирования (M.S. Lee et al., 2003). Белки, содержащие SH2-домен,
такие как GRB2 и Shc, связываются с мотивом YENPTY (консервативной для семейства APP аминокислотной последовательностью), предпочтительно, когда первый тирозин (Y) в этом мотиве фосфорилирован. Напротив, в этих условиях связывание PTB-домен содержащих белков (DAB1 и JIP1) снижается [et al., 2009].
Статус фосфорилирования АРР может быть вовлечен в патогенез БА, поскольку
t.me/medicina_free
28
было обнаружено, что Tyr757 (или 682 для АРР695) фосфорилируется больше у пациентов с БА по сравнению с контрольными пациентами [Russo et al., 2001], а
мутация Tyr757 у мышей приводит к преобладанию α-расщепления APP над β-
расщеплением [Barbagallo et al., 2010].
Известно, что протеолитическая обработка APP изменяет некоторые взаимодействия APP. Например, ShcA предпочтительно взаимодействует с C99, а
не с C83 [Repetto et al., 2004]. ShcA участвует в генерации сигнальных каскадов через активацию MAPK (митоген-активируемая протеинкиназа) [Tamayev, et al., 2009]. C99 также взаимодействует со множеством белков рецепторного комплекса
Wnt-PNP (Vangl2, Frizzeld и Frizzeld5), участвующего в регуляции клеточной полярности и роста аксонов [Soldano et al., 2013]. Следовательно,
протеолитический процессинг APP может определять активацию тех или иных сигнальных путей.
Другой интересный сайт фосфорилирования на С-конце APP - это Thr743 (или Thr688 на APP695). Непосредственно за этим сайтом фосфорилирования следует пролин. Фосфорилированные мотивы Thr-Pro в пептидах могут существовать в цис- или транс-конформациях, превращение которых катализируется пролилизомеразой Pin1. Это регулируемое фосфорилированием конформационное изменение может действовать как переключатель,
контролирующий связывание APP с различными белками и определяющий путь расщепления APP [Ando et al., 2001]. Нокаут Pin1 отдельно или в сочетании со сверхэкспрессией мутантного АРР у мышей усиливает амилоидогенный путь расщепления АРР и способствует образованию в мозге нерастворимой токсичной формы амилоида - Aβ42 [Pastorino et al., 2006]. Фрагмент APP - C99 -
предпочтительнее фосфорилируется по сайту Thr743, чем C83, а Pin1 связывается с C99, но не полноразмерным APP или C83. Это снова указывает на то, что дифференциальное расщепление APP определяет специфические последующие события [Akiyama et al., 2005].
Помимо адаптерных и сигнальных белков, С-концевой фрагмент APP также участвуют во взаимодействиях с моторными белками, такими как кинезин, миозин
t.me/medicina_free
29
и динеин. Существует предположение, что, взаимодействуя с этими белками, APP
способен контролировать собственный транспорт [Rodrigues et al., 2012]. В
частности, кинезин-1 может взаимодействовать с APP напрямую или косвенно через JIP1 [Chiba et al., 2014]. JIP1, в свою очередь, может непосредственно контролировать антероградные или ретроградные направления транспорта APP,
регулируя активность кинезина-1 и динеина [Fu et al., 2013]. Также сообщается, что
APP необходим для опосредованного кинезином аксонального транспорта везикулярных компартментов, содержащих BACE1 и пресенилин-1 [Kamal et al., 2001].
Функции протеолитических продуктов APP: β-амилоид
Амилоид β присутствует на протяжении всей жизни у когнитивно нормальных людей и выполняет определенные функции.
Кумар с соавторами продемонстрировали на мышах, нематодах и клеточных культурах с моделями БА, что Aβ защищает от грибковых и бактериальных инфекций. При этом олигомеризация Aβ может быть необходима для реализации антимикробной активности пептида. Считается, что растворимые олигомеры Aβ
сначала связываются с углеводами клеточной стенки микробов через гепарин-
связывающий домен. Затем формирующиеся протофибриллы ингибируют адгезию патогенов к клеткам хозяина. Разрастающиеся β-амилоидные фибриллы опосредуют агглютинацию связанных и захват свободных микробов [Kumar et al., 2016].
Aβ обладает также вирулицидными свойствами. Лукив с соавт. в 2010 г.
сообщили, что высокие концентрации Aβ42 ингибируют инфицирование нейроглиальных культур человека вирусом простого герпеса 1 (HSV1) так же эффективно, как и противовирусный препарат ацикловир [Lukiw et al., 2010].
Позднее Вайт с соавт. показали, что Aβ42 и, в меньшей степени, Aβ40, эффективны в предотвращении заражения культивируемых клеток пандемическими штаммами
H1N1 и H3N2 вируса гриппа [White et al., 2014].
t.me/medicina_free
30
Первичный противовирусный механизм заключается в способности амилоида-β связываться с белками вирусных оболочек. В результате вирусные частицы осаждаются и не могут инфицировать культивируемые клетки. Кроме того, предварительная инкубация вирусов с растворимым Aβ стимулирует последующее поглощение вирусов фагоцитами, но вирусы не реплицируются в этих клетках, что указывает на то, что агрегированные вирусные частицы нейтрализуются амилоидом-β. Aβ неэффективен в отношении аденовируса человека, не имеющего липопротеиновой оболочки [Bourgade et al., 2015; White et al., 2018].
Данные исследований на животных показали, что продукция Aβ возрастает в ответ на инфицирование патогенами и уменьшается при выздоровлении.
Например, отложения Aβ были отмечены у мышей дикого типа, инфицированных хламидофилой пневмонии [Little et al., 2004; Little et al., 2014], HSV1 [Wozniak et al., 2007], вирусом псевдобешенства [Tanaka et al., 2018], токсоплазмой гондии
[Torres et al., 2018]. У трансгенных мышей с моделью БА, инфицированных порфиромонас гингивалис, также наблюдалось повышение отложения амилоида-β [Ishida et al., 2017]. Примечательно, что уровень Aβ снижался по мере того, как инфекция хламидофилой пневмонии проходила [Little et al., 2014].
У пациентов c нейроборрелиозом Лайма и пациентов с бактериальным менингитом уровни sAPPα и Aβ в спинномозговой жидкости снижаются, что указывает на то, что данные пептиды секвестрируются в мозге. После выздоровления уровни пептидов в спинномозговой жидкости возвращаются к норме [Krut et al., 2013; Sjogren et al., 2001].
В амилоидных бляшках или головном мозге людей с болезнью Альцгеймера обнаруживаются различные виды микробов и следы вирусных частиц. В частности,
в ядрах бляшек были обнаружены ДНК вируса простого герпеса 1 [Wozniak et al., 2009], антигены и ДНК спирохет [Miklossy, 2016], в паренхиме мозга -
хламидофилы пневмонии, в нейронах - различные грибковые инфекции и хламидофилы пневмонии [Hammond et al., 2010; Pisa et al., 2015].
t.me/medicina_free
