
3 курс / Патологическая физиология / Атеросклероз_сосудов_сердца_и_головного_мозга
.pdf
30 |
Глава 2. ФИЗИОЛОГИЯ СЕРДЕЧНО СОСУДИСТОЙ СИСТЕМЫ. ПРИНЦИПЫ РЕГУЛЯЦИИ... |
Рис. 13. Принцип центральной регуляции сердечно со судистой системы: 1 – медуллярный сердечно сосудис тый центр; 2 – бульбо спинальный вазомоторный центр; 3 – кардиальные, пульмональные, сосудистые (каротидные, аортальные) механорецепторы; 4 – каротидные и пери ферические хеморецепторы. ЛК – легочный кровоток; ЛП
– левое предсердие; ЛЖ – левый желудочек; ПП – правое предсердие; ПЖ – правый желудочек; ПК – периферичес кое кровообращение
Вместе с этим надо заметить, что регуляция кровообращения обеспечивается влиянием не только нервнорефлекторных импульсов*, но и действием гуморальных факторов*. Среди последних выделяют системные (гормоны) и местные (вазоактивные вещества, продукты метаболизма) химические соединения, способные влиять на функцию сердечно-сосудистой системы. При этом B. Zweifach [25] указывает, что чем меньше диаметр терминальных (концевых) сосудов, тем большую роль в регуляции их функции играют гуморальные факторы.
Гуморальные факторы регуляции кровообращения
Все химические вещества в организме, способные оказывать влияние на сосуды, можно разделить на несколько групп [7]:
1.Неспецифические продукты аэробного и анаэробного обмена, характерные для всех органов и тканей, образующиеся в результате электрогенеза клеток и накапливающиеся в околососудистой (периваскулярной) среде.
2.Кислород, точнее его недостаток, который возникает всякий раз, когда нарушается соответствие между его доставкой и потреблением.
3.Тканевые гормоны и вазоактивные вещества, вырабатываемые местно в специализированных структурах органов и тканей (в нервных окончаниях, железистых, тучных, ретикулоэндотелиальных клетках). Для этих веществ характерно местное действие на тонус близлежащих сосудов, некоторые из них, попадая в кровеносное русло, оказывают влияние на сосуды вне мест своего образования.
4.Гормоны желез внутренней секреции, разносимые кровью по всей сердечно-сосудистой системе и способные влиять на тонус сосудов разных органов как непосредственно (катехоламины, ангиотензин, вазопрессин и др.), так и опосредованно через изменение метаболизма, электролитного баланса (адренокортикотропный гормон, кортикоиды, тироксин, инсулин). Представители этой группы химических факторов являются одним из звеньев нейрогормональной регуляции кровообращения и не относятся, следовательно, к местным факторам регуляции сосудистого тонуса.
Здесь надо заметить, что разносимые кровью вещества оказывают влияние на сократительные элементы пре- и посткапиллярных сосудов непосредственно из кровотока, а все вещества, вырабатываемые тканевыми клетками, действуют на регионарные сосуды главным образом снаружи [3].
Высокоактивные эндогенные биологически активные вещества, часть из которых перечислена ниже, переносятся кровью к органам-мишеням и оказывают прямое или опосредованное, путем изменения функциональной активности органа, влияние на регионарные артериальные и венозные сосуды, а также на сердце. Все эти вещества могут считаться факторами гуморальной регуляции сердечно-сосудистой системы.
• Катехоламины. Разработка высокочувствительных методов определения концентраций норадреналина, адреналина, дофамина в плазме крови позволила по-новому оценить физиологическое значение катехоламинов как факторов гуморальной регуляции. Как известно, норадреналин является основным медиатором периферического отдела симпатической вегетативной нервной системы, и главной его функцией следует счи- тать участие в нейрогенной регуляции сосудистого тонуса, участие в реакциях перераспределения сердеч- ного выброса.
Главным источником определяемого в крови адреналина являются хромафинные клетки мозгового слоя надпочечников. Повышение системного АД и развитие тахикардии при стрессе в сочетании с высоким содержанием адреналина в крови позволяет большинству исследователей считать адреналин ответственным за гемодинамические проявления стрессовой реакции. Интересно, что, несмотря на отсутствие выраженных адреналинзависимых изменений системной гемодинамики, адреналин при стрессе способен вызывать расшире-
Гуморальные факторы регуляции кровообращения |
31 |
ние сосудов головного мозга и сердца за счет активации β -адренорецепторов [25].
Суммируя данные литературы, можно заключить, что в физиологических условиях норадреналин оказывает свой эффект в местах выделения из симпатических окончаний, то есть является медиатором, реализующим нервные влияния на сердце и сосуды. Концентрации норадреналина в крови обычно ниже тех, которые вызывают прямые эффекты на сердце и сосуды. Адреналин, выбрасываемый при стрессе из надпочечников, вызывает, прежде всего, развитие гипергликемии, в больших концентрациях может расширять мозговые и коронарные артерии, повышать тонус вен. Остальные, хорошо известные эффекты адреналина связаны с действием больших, часто нефизиологических, концентраций этого катехоламина в крови.
•Ренин-ангиотензиновая система. Ренин – это фермент, который вырабатывается и хранится в юкстаг-
ломерулярных* клетках почек. Высвобождаясь в кровь, этот фермент расщепляет ангиотензиноген (α 2-глобу- лин), синтезирующийся в печени. В результате образуется декапептид анигиотензин I. Под действием «конвертирующего фермента» плазмы ангиотензин I превращается в ангиотензин II.
При снижении кровоснабжения почек любой этиологии выделение ренина увеличивается. Полагают, что выброс ренина стимулируется также изменением концентрации электролитов в крови [26].
Ангиотензин II оказывает очень сильное прямое сосудосуживающее действие на артерии, обусловленное наличием чувствительных к нему рецепторов на поверхности гладкомышечных клеток, и менее сильное – на вены. Кроме того, он возбуждает центральные и периферические симпатические структуры, в результате чего повышается периферическое сосудистое сопротивление
èкровяное давление. И, кроме этого, ангиотензин II служит главным стимулятором выработки альдостерона* в коре надпочечников. Доказано, что наряду со способностью прямого воздействия на тонус сосудов и модуляции выброса медиатора на периферии, ангиотензин II может проникать в мозг в областях со слабо развитым гематоэнцефалическим барьером*, что сопровождается центральной активацией симпатической системы и угнетением сердечного компонента барорецепторного рефлекса [27].
•Альдостерон способствует повышению содержания в организме натрия и внеклеточной жидкости. В то же время он повышает чувствительность мышц сосудов к вазоконстрикторным агентам, усиливая тем самым прессорное действие ангиотензина II. При активации ренин-ангиотензиновой системы концентрация альдостерона в крови повышается. С учетом такой тесной взаимосвязи между ренином, ангиотензином и альдостероном их эффекты часто объединяют в одном названии – ренин-ангиотензин-альдостероновая система.
•Вазопрессин*, или антидиуретический гормон в
средних и высоких дозах оказывает сосудосуживающее действие, наиболее выраженное на уровне артериол, путем взаимодействия с V1 вазопрессиновыми рецепторами на мембране гладкомышечной клетки. Однако, главным эффектом вазопрессина является регуляция реабсорбции воды в дистальных канальцах по- чек. В связи с этим он играет особую роль в регуляции объема жидкости в организме и поддержании объема внутрисосудистого водного пространства. Так, при увеличении объема циркулирующей крови импульсация от рецепторов предсердий (см. раздел 2.1) возрастает, и в результате выделение вазопрессина снижается, что приводит к увеличению выведения жидкости почками. При падении системного АД происходят обратные процессы: выброс вазопрессина увеличивается и выделение жидкости уменьшается. Этот нейрогормональный рефлекс на внезапные изменения внутрисосудистого объема крови, служащий для регуляции объема жидкости, называют рефлексом Гауэра–Генри [28].
Специфической особенностью плазменного вазопрессина является его способность проникать в мозг и повышать чувствительность сердечного и сосудистого компонентов барорецепторного рефлекса [25].
•Калликреин-кининовая система. Калликреин представляет собой фермент, содержащийся в тканях и
плазме обычно в неактивной форме. После активации калликреин расщепляет α 2-глобулин плазмы – клининоген, в результате чего образуется декапептид каллидин, превращающийся после отщепления лизина в нонапептид брадикинин. Относящиеся к группе нейровазоактивных пептидов*, каллидин и брадикинин обладают широким спектром биологического действия, в частности, они вызывают расширение просвета периферических и коронарных сосудов, снижают АД, увеличивают ЧСС, повышают проницаемость капилляров [24].
•Серотонин (5-гидрокситриптамин) – биологически активное соединение из группы биогенных аминов; содержится во внутренних органах и тромбоцитах. Он оказывает сосудосуживающий эффект и повышает проницаемость капилляров. Мощное вазоконстрикторное влияние серотонина на артерии мягкой мозговой оболочки может играть роль в возникновении их спазмов
[29].Сосудосуживающее действие серотонина, выделяющегося при агрегации* тромбоцитов, способствует закрытию сосуда и, при его повреждении, остановке кровотечения. Ингибитором* сертонина служит фермент моноаминоксидаза*.
•Простагландины представляют собой гормоноподобные вещества, которые синтезируются из полиненасыщенных жирных кислот – арахидоновой и линолевой, входящих в состав фосфолипидных фракций клеточных мембран. Простагландины, простациклин и тромбоксан образуются почти во всех органах и тканях. Причем, простациклин тормозит агрегацию тромбоцитов, а тромбоксан способствует агрегации тромбоцитов и, кроме того, действует как сосудосуживающее вещество [24].
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
32 |
Глава 2. ФИЗИОЛОГИЯ СЕРДЕЧНО#СОСУДИСТОЙ СИСТЕМЫ. ПРИНЦИПЫ РЕГУЛЯЦИИ... |
• Предсердный натрийуретический пептид является высокоактивным циркулирующим в крови веществом, выделяемым микроэндокринными клетками предсердий [30]. Физиологические эффекты этого гормона реализуются путем активации специфических рецепторов на клеточных мембранах многочисленных органовмишеней – почек, гладких мышц сосудов, надпочечников. Среди огромного количества работ, посвященных изучению физиологических эффектов предсердного натрийуретического пептида, наиболее часто встречаются указания на его способность расширять сосуды и вызывать гипотонию, усиливать диурез и натрийурез, угнетать активность симпатической нервной системы, ингибировать выброс альдостерона и вазопрессина [30–32].
Приведенные данные свидетельствуют о возможности гуморальной регуляции функции сердечно-сосуди- стой системы. Механизм действия рассмотренных факторов на систему кровообращения включает не только прямое взаимодействие с рецепторами клеточных эле-
1Лимбико#гипоталамический уровень
|
I |
|
|
II |
А |
|
|
|
III |
|
Б |
|
|
|
|
|
В |
2Бульбо#спинальный уровень
IV |
V |
Г
3Местный уровень
Д
VI |
VII |
Рис. 14. Основные уровни регуляции сердечно сосудис той системы [3, 25]. I – кора мозга; II – гипоталамус; III – внешние стимулы; IV – барорецепторы (рецепторы растя жения); V – хеморецепторы; VI – сердце; VII – артериаль ные сосуды. А – соматосенсорные (поведенческие) реак ции; Б – висцеромоторные (сердечно сосудистые и др.) реакции; В – гормональные реакции; Г – нейрогумораль ная регуляция кровообращения; Д – миогенная активность (местны е механизм ы положительно й и отрицательной обратной связи)
ментов сосудистой стенки, но также модуляцию* выхода медиатора из симпатических окончаний и влияние на центральные механизмы регуляции системной и регионарной гемодинамики.
При рассмотрении всего комплекса механизмов, определяющих основные принципы регуляции сердечнососудистой системы, принято условно подразделять их на уровни, различающиеся как по анатомической локализации участвующих в регуляции структур мозга, так и по решаемым на этих уровнях задачам. Выделяют лим- бико-гипоталамический, бульбо-спинальный и местный уровень регуляции (рис. 14). Современные физиологические представления базируются на идее иерархической структуры управляющего аппарата, согласно которой каждый вышестоящий уровень регуляции способен модулировать работу нижележащих уровней [3, 25, 33].
Учитывая особенности задач, стоявших перед авторами этой книги, представляется логичным отдельное рассмотрение роли сердца в общей схеме нервной регуляции кровообращения.
2.1. РЕГУЛЯЦИЯ ДЕЯТЕЛЬНОСТИ СЕРДЦА
Основной задачей сердца является поддержание необходимого для кровотока напора (уровня давления) крови в артериальной системе. Величина этого давления зависит от объема крови, выброшенной сердцем в артериальную систему, и периферического сопротивления артериальных сосудов.
Периферическое сопротивление меняется в зависимости от изменения тонуса артериол, величина которого зависит от потребностей тканей в оксигенированной крови. Сердечный выброс зависит от количества крови, притекающей к сердцу по венам, а это количество в свою очередь определяется уровнем физической и эмоциональной активности организма, вызывающих изменение тонуса вен, и от емкости кровяных депо [34].
Механизмы, регулирующие работу сердца, должны учитывать непрерывные изменения указанных факторов и, в соответствии с этим, менять деятельность сердца, чтобы во всех случаях обеспечить поддержание необходимого уровня давления крови в артериальной системе. Эти сложные задачи выполняются нервными механизмами, регулирующими работу сердца.
В тесной связи с нервными воздействиями находятся и гуморальные влияния, изменяющие порог реакций тканей сердца на миогенные и нервные факторы регуляции. Это обеспечивает достижение оптимальных результатов минимальными средствами каждой из систем регуляции.
Нервная регуляция сердца
Всем нам хорошо известно эмоциогенное усиление деятельности сердца в виде ощущения сильных ударов в
2.1. Регуляция деятельности сердца |
33 |
левой половине грудной клетки и сердцебиения. Здесь вполне уместно привести слова У. Гарвея из его знаменитого труда о движении крови, вышедшего более трех столетий тому назад: «… все движения души – горе, радость, надежда, волнение, возбуждающие ум человека, отзываются на сердце и производят в нем изменения устройства и деятельности его» [2].
Центральная нервная система через экстракардиальные центробежные (эфферентные) нервы оказывает регулирующее влияние на разные стороны деятельности сердца, обеспечивая срочное приспособление его работы к меняющимся условиям существования организма.
Первые точные сведения о влиянии нервов на сердце были получены в 1846 г. братьями А. и Е. Weber, открывшими тормозное влияние блуждающего нерва на сердце. Затем A. Bezold и братья E. и F. Cyon в 1863– 1866 гг. описали учащение сердцебиений при стимуляции идущих к нему симпатических волокон (цит. по [35]). И в наши дни тормозящее действие волокон блуждающего нерва на сердце, равно как и стимулирующее сердечную деятельность влияние симпатических волокон, принадлежат к наиболее бесспорно и неопровержимо установленным фактам физиологии.
В 80-х годах 19-го века И.П. Павловым [36] и W. Gaskell [37] было показано, что возбуждение сердечных симпатических нервов может увеличивать силу сердеч- ных сокращений без изменения их ритма, а возбуждение блуждающего нерва может приводить к ослаблению интенсивности сокращения. Влияния на частоту сокращений получили название хронотропных, а влияние на силу – инотропных эффектов. Причем, при урежении и ослаблении сокращений сердца говорят об отрицательных, а при их учащении и усилении – о положительных хронотропных и инотропных эффектах или влияниях [35].
Примерно в те же годы были описаны влияния сердечных нервов (положительные и отрицательные) на проводимость сердца, то есть на скорость распространения возбуждения по проводящей системе [38]. Влияния на проводимость обозначаются как дромотропные, и на возбудимость сердца – как батмотропные.
Следующим важнейшим этапом развития учения об иннервации сердца, также сильно отразившемся на всем развитии физиологии, было открытие O. Loewy в 1921 г. механизма гуморального переноса нервных влияний, осуществляемых микросекрецией из терминалей парасимпатических нервных волокон ацетилхолина, а из окончаний постганглионарных симпатических волокон
– норадреналина [39]. В связи с этим, как мы уже указывали, все волокна парасимпатической системы обозна- чаются как холинергические, а постганглионарные симпатические волокна, медиатором действия которых являются катехоламины, как адренергические [16–21; 33–35].
При возбуждении симпатических нервов значительно увеличивается частота сердечных сокращений, что
обнаруживали практически все авторы, исследовавшие функцию сердца. Выделение большого количества норадреналина из окончаний симпатических нервов при их раздражении позволило E. Braunwald назвать сердце эндокринным органом (цит. по [40]).
Раздражение симпатических нервов влияет на соотношение между конечным диастолическим давлением (или объемом) и силой сокращения желудочков сердца, известное как закономерность Франка-Старлинга. Существенное влияние оказывают симпатические нервы и на податливость миокарда: уменьшается остаточный объем, укорачивается время изгнания, увеличиваются объем и скорость изгнания крови из желудочков, возрастают показатели сократимости миокарда [34, 35, 40].
Помимо положительного инотропного действия, регуляции локальной и общей сократимости, управления частотой сокращений, влияний на проводимость и возбудимость миокарда, симпатическая нервная система оказывает прямое трофическое влияние на ткани сердца [40].
Возбуждение блуждающего нерва неизменно вызывает урежение сердечных сокращений, выраженное тем больше, чем сильнее это раздражение. При этом торможение сердечной деятельности может выражаться в виде не только урежения сердцебиений, но и полной остановки сердца.
Âотдельных случаях и в особых условиях при раздражении блуждающего нерва можно наблюдать иногда учащение сердечных сокращений, что обычно объясняют присутствием в стволе этого нерва сердечных симпатических волокон с присущим им ускорительным действием [40].
Âнастоящее время прямое отрицательное инотропное действие блуждающих нервов на сердце не вызывает сомнений. Экспериментально в условиях постоянства венозного притока, частоты сердцебиений, исклю- чения сокращений предсердий показано отрицательное инотропное действие блуждающих нервов на желудочки [3, 35].
Непосредственное соседство окончаний симпатических и парасимпатических волокон в тканях сердца, постоянно идущая по этим волокнам импульсация позволяет предполагать тесное взаимодействие симпатических
èпарасимпатических влияний на сердце.
На протяжении более 100 лет со времени открытия вагусного торможения и симпатического ускорения работы сердца проблема взаимодействия этих двух систем решалась однозначно. Оба отдела вегетативной нервной системы регулируют работу сердца по принципу реципрокности: активация одного автоматически приводит к ослаблению влияний другого. Эта точка зрения подкреплялась разнообразными данными, полученными преимущественно в острых опытах. Так, хорошо известны противоположные по знаку реакции, получаемые при введении в сердце медиаторов нервного действия – ацетилхолина и норадреналина [35, 40].
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
34 |
Глава 2. ФИЗИОЛОГИЯ СЕРДЕЧНО#СОСУДИСТОЙ СИСТЕМЫ. ПРИНЦИПЫ РЕГУЛЯЦИИ... |
Сравнительно новая концепция об акцентированном антагонизме симпатических и вагусных влияний на сердце основана на следующих наблюдениях: на фоне усиленных реакций адренергического характера влияние блуждающего нерва (ослабляющее или тормозящее деятельность сердца) проявляется сильнее, чем при изолированном возбуждении парасимпатической иннервации [40]. Такая точка зрения расширяет представление о взаимодействии симпатического и парасимпатического отделов и оставляет принципу реципрокности место частного случая в нервной регуляции сердца. По-видимому, в регуляции сердца центральная нервная система использует в разных ситуациях разнообразные варианты и степени активации и торможения обоих управляющих механизмов для достижения оптимальных результатов в поддержании необходимого уровня кровообращения.
Сердце как рефлексогенная зона
Во всех отделах сердца и в непосредственно примыкающих к нему сосудах содержится большое число воспринимающих нервных образований – нейрорецепторов, связанных афферентными (центростремительными) нервными волокнами с центральной нервной системой.
Еще в конце XIX века A. Dogiel обнаружил, что в сердце на единицу площади приходится больше рецепторных нервных окончаний, чем в наиболее богатых рецепторами участках кожи [41]. Этот факт нам представляется чрезвычайно важным для понимания патогенеза рефлекторных нарушений системной и регионарной, в частности мозговой, гемодинамики при ухудшении кровоснабжения и функциональной активности сердца.
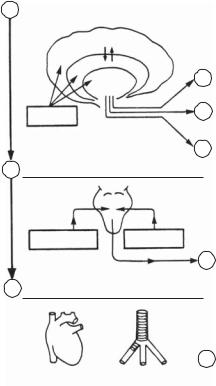
Рецепторы сердца – это по преимуществу механорецепторные образования. Среди них, видимо, немало и хеморецепторов, которые обнаружены во всех слоях сердца – в эпикарде, миокарде, эндокарде [42]. Механорецепторы сосредоточены по преимуществу на «входе»
– в венозных приемниках сердца и на «выходе» – в желудочках и в областях артериальных конусов (рис. 15).
В обоих предсердиях расположены рецепторы растяжения. Они подразделяются на два функционально важных класса: рецепторы А-типа возбуждаются при сокращении предсердий, а рецепторы В-типа – в конце систолы желудочков. При этом А-рецепторы реагируют на сокращение миокарда предсердий, а В-рецепторы – на его пассивное растяжение (увеличение внутрипредсердного давления). Импульсы от рецепторов предсердий поступают по чувствительным волокнам блуждающих нервов к циркуляторным центрам продолговатого мозга и к другим отделам центральной нервной системы [24].
К рефлексам с рецепторов сердца относят описанное K. Bainbridge еще в 1915 г. учащение сердцебиений после внутривенного введения изотонического раствора хлорида натрия или крови. К аналогичным изменениям приводило растяжение баллончиком правого пред-
сердия [43]. При более подробных исследованиях этого рефлекса (Бейнбриджа) в нем было выявлено много противоречий: в ряде случаев вместо тахикардии возникала брадикардия, или же ритм сердцебиений не менялся [40].
Дальнейшие исследования рефлекса Бейнбриджа позволили получить существенное дополнение к его характеристике [42]. Это дополнение обнаруживает связь рефлекса Бейнбриджа с законом Франка-Старлинга (повышение силы сокращения желудочка сердца при увеличении его конечного диастолического объема). Было показано, что при увеличении наполнения предсердий происходило не только ускорение расслабления, но и более полное расслабление миокарда желудочков. Адаптивность такой реакции очевидна: при избыточном наполнении предсердий желудочки начинают работать в таком режиме, чтобы быстрее разгрузить повышенный приток крови. Увеличение же степени расслабления миокарда (и удлинение его волокон) переводит соотношение Франка-Старлинга длина–сила на более высокий уровень, и сердце начинает сокращаться сильнее. Так, механизм, присущий сердечной мышце в целом сердце, усложняется и совершенствуется надстройкой нервной регуляции [44].
Рефлекторные реакции, возникающие при возбуждении одних только В-рецепторов предсердий, во многом сходны с эффектами возбуждения сосудистых барорецепторов. К этим реакциям относятся торможение симпатического и возбуждение парасимпатического отделов циркуляторных нервных центров продолговатого мозга. Импульсы от предсердных механорецепторов В-типа оказывают особенно выраженное сосудосуживающее
2
1
А |
Б |
Рис . 15 . Расположение внутрисердечных рецепторных полей [42]. А – скопление механорецепторов в венозных приемниках предсердий: 1 – рецепторы у мест впадения легочных вен; 2 – рецепторы у мест впадения верхней и нижней полых вен. Б – скопление механорецепторов в мио карде: 3 – рецепторы в области корня легочной артерии; 4 – рецепторы в области корня аорты
2.1. Регуляция деятельности сердца |
35 |
влияние на почечные сосуды, в то время как в рефлексах с артериальных барорецепторов участвуют преимущественно сосуды скелетных мышц. Таким образом, активность В-рецепторов предсердий, по-видимому, влияет главным образом на уровень почечной экскреции, зависящей в известной степени от почечного кровотока.
Рецепторы предсердий играют также особую роль в регуляции внутрисосудистого объема крови. Это связано с их расположением, идеальным для восприятия степени наполнения сосудистой системы и динамики наполнения желудочков. Рецепторы предсердий и крупных вен очень чувствительны к этим параметрам, поэтому малейшие колебания внутрисосудистого объема крови вызывают изменения импульсации от этих рецепторов, поступающей, в частности, к центрам осморегуляции в гипоталамусе. Эти центры контролируют секрецию гормона вазопрессина [24, 40].
Сигналы от предсердных А-рецепторов (в отличие от В-рецепторов), очевидно, повышают симпатический тонус. Именно возбуждением этих рецепторов объясняют тахикардию, часто (но не всегда) возникающую в эксперименте при очень сильном растяжении предсердий, вызванным быстрым введением в кровоток большого объема жидкости. Непостоянство этого рефлекса может быть связано с различиями в степени возбуждения предсердных А-и В-рецепторов в разных условиях эксперимента; поэтому физиологическое значение рефлекса Бейнбриджа спорно [24].
В желудочках также имеется некоторое количество рецепторов растяжения. Афферентные волокна от этих рецепторов, как и от рецепторов предсердий, идут в составе блуждающих нервов. Импульсация от рецепторов желудочков регистрируется только во время фазы изоволюмического сокращения.
Полагают, что в покое импульсы от рецепторов желудочков поддерживают отрицательное хронотропное влияние блуждающих нервов на сердечный ритм и при очень сильном растяжении желудочков вызывают рефлекторную брадикардию и вазодилатацию [24], однако физиологическое значение этих реакций еще не выяснено.
Левый желудочек, левое предсердие и легочные вены являются источником многообразных рефлекторных изменений кровообращения и дыхания, в том числе влияний на ритм сердцебиений, объем циркулирующей крови, венозный приток к правому предсердию [42, 44]. Примером такого рефлекторного влияния на систему сосудов легочной артерии и на биоэлектрическую активность миокарда правого предсердия может служить так называемый рефлекс Китаева [45]. Повышение давления в левом предсердии и легочных венах вызывает рефлекторное сужение артериол системы легочной артерии и уменьшение притока крови к левому предсердию. Этим предотвращается перегрузка левого сердца и отек легких, возможные при некоторых пороках сердца.
Увеличение объема крови в правом предсердии, воз-
никающее вследствие таких рефлекторных влияний, сопровождается рефлекторной брадикардией и депонированием крови, которые приводят к разгрузке правого сердца. Кроме того, при повышении давления в сосудистом русле малого круга кровообращения возникает депрессорный рефлекс Парина – брадикардия, гипотензия и увеличение селезенки вследствие депонирования в ней крови [46].
Рефлексы Китаева и Парина тесно связаны с другим рефлекторным актом – регуляцией объема циркулирующей крови. Это рефлекс Генри-Гауэра [28] – усиление диуреза при повышении давления в магистральных венах и предсердиях. Он служит примером сложного рефлекса, эфферентным звеном которого является гуморальная система (торможение выделения антидиуретического гормона, увеличение секреции альдостерона) [40].
Рефлекс Бецольда-Яриша [47, 48] проявляется в рефлекторной брадикардии, вазодилатации, гипотензии и угнетении дыхания в результате афферентной импульсации с хеморецепторов сердца при внутривенном введении некоторых фармакологических препаратов, например, алкалоидов чемерицы (veratrium), никотина, серотонина и др. [24, 35, 44].
Аналогичные реакции со стороны сердца и сосудов наблюдаются при нанесении этих веществ на поверхность левого желудочка или при введении в левую венечную артерию (коронарный хеморефлекс). Остановка дыхания связана с действием этих агентов на рецепторы легких.
Коронарный хеморефлекс может иметь место при состояниях, характеризующихся активацией симпатикоадреналовой системы, в частности, при физической нагрузке. Кроме того, многочисленные экспериментальные данные о рефлекторных реакциях при локальной ишемии миокарда позволяют считать, что коронарным хеморефлексам может принадлежать существенная роль в развитии ряда патологических состояний сердечно-со- судистой системы, таких как стенокардия и инфаркт миокарда [40, 44].
Приведенные данные свидетельствуют, что внутрисердечная нервная система, по-видимому, может обеспечивать периферические рефлексы, имеющие значение в саморегуляции кровообращения. При этом отмечается разнообразие регуляторных влияний внутрисердечной нервной системы – наблюдается как угнетение, так и усиление деятельности сердца. Степень возбудимости и другие свойства сердечной мышцы также меняются в различных направлениях в зависимости от исходного («фонового») растяжения стенок предсердий и желудочков. При переполнении камер сердца кровью дополнительное растяжение миокарда вызывает отрицательные инотропные и батмотропные эффекты, а при осуществлении внутрисердечных рефлексов на фоне низкого внутрисердечного давления возбудимость и сила сокращений миокарда увеличиваются.
Для объяснения взаимосвязи интракардиальных
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
36 |
Глава 2. ФИЗИОЛОГИЯ СЕРДЕЧНО#СОСУДИСТОЙ СИСТЕМЫ. ПРИНЦИПЫ РЕГУЛЯЦИИ... |
|
7 |
3 |
7 |
5 |
8 |
64
1
2
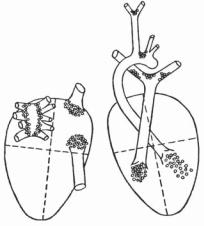
Рис. 16. Схема взаимоотношений интракардиальной и эк стракардиальной нервной системы [49]. 1 – миокардиаль ная ткань; 2 – рецепторы растяжения миокарда (механо рецепторы); 3 – афферентные нейроны; 4 – холинерги ческий эфферентный нейрон; 5 – адренергический эф ферентный нейрон; 6 – вставочный тормозной нейрон; 7
– преганглионарные волокна блуждающего нерва; 8 – во локна симпатической нервной системы
и экстракардиальных нервных механизмов, регулирующих работу сердца, Г.И. Косицким была предложена гипотетическая схема структуры внутрисердечной нервной системы (рис. 16). Согласно этой концепции [49], среди интракардиальных нервных клеток, наряду с афферентными нейронами, дендриты которых образуют рецепторы растяжения миокарда и коронарных сосудов, и эфферентными холинергическими и адренергическими нейронами, возможно, имеются вставочные нейроны, тормозящие адренергические нервные клетки при значительных раздражениях преганглионарных волокон блуждающих нервов или же при сильном растяжении миокарда.
Эти данные позволяют считать, что традиционные представления о нервной регуляции деятельности сердца должны быть дополнены данными об участии внутрисердечной нервной системы в процессах управления кровообращением.
Эндокринная функция сердца
Еще в 1956 г. B. Kisch, а в 1964 г. J. Jamieson и G. Polade обнаружили в клетках предсердий млекопитающих и человека электронно-плотные гранулы, имеющие характер специфических секреторных структур, сходные с гранулами в клетках некоторых эндокринных органов (цит. по [50]). Было показано, что внутривенное введение экстрата гомогената предсердий крыс вызывает быстрое, почти 30-кратное повышение натрийуреза и хло-
руреза. Одновременно с повышением выведения из организма натрия происходило понижение системного АД и повышение гематокрита [51]. В последующие годы из кардиоцитов предсердий были синтезированы вещества пептидной природы. Этому низкомолекулярному пептиду давались различные названия: предсердный натрийуретический пептид (фактор, гормон), атриальный натрийуретический фактор, предсердный гормон, аурикулин, кардиодилатин, атриопептин [30–32; 52].
• Атриальный натрийуретический фактор
(АНФ), помимо миокарда предсердий, обнаружен в миокарде желудочков и проводящей системе сердца. Полагают, что элементы проводящей системы являются дополнительным местом синтеза АНФ. Важно, что на высвобождение АНФ из кардиоцитов предсердий непосредственно влияет механическое растяжение их стенок [30, 52]. Увеличение объема циркулирующей крови путем введения изотонического раствора или обильного питья воды также значительно повышало концентрацию АНФ в плазме крови [32, 52].
Основными органами-мишенями для АНФ являются почки, сосуды, надпочечники и некоторые структуры центральной и симпатической нервной системы, в которых были найдены специфические для АНФ белки-ре- цепторы, обусловливающие физиологические эффекты этого гормона.
Сосудорасширяющий и натрийуретический эффекты АНФ, его способность тормозить секрецию ренина и альдостерона, наконец, наличие специфических рецепторов АНФ в сосудах, почках, клубочковой зоне коры надпо- чечников заставляют думать, что АНФ играет важную роль в сопряжении элементов ренин-анготензин-альдос- тероновой системы, регулирующей водно-солевой баланс организма [25, 53].
Атриопептины отвечают требованиям, предъявляемым к понятию гормон: наличие единого источника секреции, прямое выделение в кровь, длительная циркуляция в ней, дистантное и специфическое действие. В то же время они обладают и существенными особенностями (вырабатываются не только в сердце, но и в мозге, могут оказывать местное действие в ЦНС, мишени их не единичны), сближающими их с нейропептидами [53]. В регуляции секреции АНФ важную роль играют механизмы обратных связей: регулируя гемодинамику и связанные с ней аспекты гомеостаза, АНФ секретируется в зависимости от сигналов, характеризующих величину или знак определенных отклонений в регулируемых функциях.
Значение этих данных заключается в дальнейшем изучении роли АНФ в патогенезе артериальных гипертензий, сердечной недостаточности и отеков, развивающихся при различных заболеваниях. Одним из наиболее увлекательных аспектов изучения АНФ, обладающего столь широким спектром биологических свойств, является исследование возможности его лечебного применения.

2.2. Контуры регуляции тонуса сосудов |
37 |
Наряду с АНФ, ткань предсердия способна вырабатывать тромбоксан (ÒõÀ2), который может играть важную роль в регуляции коронарного кровотока [54].
• Ренин-ангиотензиновая система сердца. Установлено, что ренин и ангиотензиноген синтезируются во многих тканях организма, и ангиотензин, образуемый эндогенной ренин-анигиотензиновой системой может оказывать существенное влияние на функцию локальной ткани [24, 27]. Имеется довольно подробное описание сосудистой, мозговой и почечной ренин-ангиотен- зиновых систем [55]. Вызывают интерес обнаружение ренин-ангиотензиновой системы в сердечной ткани, изу- чение факторов, регулирующих эту систему, и обсуждение возможного функционального значения локального синтеза ангиотензина в сердце [56, 57].
О регуляции сердечного ренин-ангиотензина известно немного. Было изучено влияние натриевого статуса на уровень сердечного ренина и ангиотензиногена. В сердце животных, лишенных натрия, содержался гораздо более высокий уровень ренина и ангиотензиногена, чем в сердце животных, перегруженных натрием. Увеличение содержания сердечного и почечного ренина было обнаружено также в результате стимуляции β -ад- ренорецепторов синтетическим катехоламином изопротеренолом [58].
Возможные функции сердечной ренин-ангиотензино- вой системы можно суммировать следующим образом: сужение коронарных сосудов, увеличение сократительной активности миокарда, стимуляция роста кардиомиоцитов, влияние на обмен веществ в миокарде, а также на желудоч- ковые аритмии при ишемии [57]. Сердечный ангиотензин может оказывать влияние на сердечную функцию непосредственно – путем активации ангиотензиновых рецепторов кардиомиоцитов гладкомышечных клеток коронарных артерий или косвенно – путем освобождения норадреналина из адренергических нервных окончаний [55, 56].
Под действием ангиотензина увеличивается синтез белка и клеточной массы сердечных и сосудистых миоцитов. Усиленное образование сосудистого ангиотензина в области поражения или воспаления может привести к чрезмерному сужению или спазму сосудов [56]. Подавление фермента, трансформирующего сердечный ангиотензин, может иметь важные фармакологические последствия при ишемии, гипертрофии или недостаточ- ности сердца.
Таким образом, до недавнего времени сердце рассматривалось лишь как орган-насос, обеспечивающий движение крови в системе кровообращения. Обнаружение эндокринной функции сердца существенно меняет представления об этом органе и свидетельствует о его еще большей роли в регуляции системной и регионарной гемодинамики, чем предполагалось ранее.
При рассмотрении всего комплекса механизмов регуляции сердечно-сосудистой системы конечным результатом их взаимодействия является адекватное снабжение органов и тканей организма оксигенированной кро-
вью во всем диапазоне изменений функциональной активности организма.
2.2. КОНТУРЫ РЕГУЛЯЦИИ ТОНУСА СОСУДОВ
Базальный сосудистый тонус и функция сердца являются той основой, на которую накладываются различ- ной природы регуляторные воздействия. Сложно организованное регулирование кровообращения обеспечи- вает, во-первых, сохранение циркуляторного гомеостаза или, другими словами, поддержание оптимальных значений показателей кровообращения – системного АД, сердечного выброса и суммарного сопротивления сосудистой системы; во-вторых, – адекватное кровоснабжение отдельных органов и тканей соответственно особенностям их метаболизма. При этом происходит перераспределение кровотока между различными сосудистыми бассейнами с учетом их значимости в конкретных ситуациях.
Регуляция деятельности сосудистой системы обеспечивается несколькими путями поступления информации в управляющие центры и целым рядом относительно независимых друг от друга исполнительных звеньев.
В обобщенном виде кровеносный сосуд испытывает несколько влияний различной природы (рис. 17), одни из которых определяют его базальный тонус, а другие – направленность его изменений разного рода регуляторными воздействиями, к которым можно отнести следующие [3, 12]:
1.Нейрогенные влияния, способные как повышать, так и понижать сосудистый тонус.
2.Механические влияния, например, растяжение сосуда под действием изменений трансмурального давления.
5
1, 2
4 |
|
3 |
|
|
|
|
|
|
Рис. 17. Основные механизмы регуляции сосудистого тону са: 1 – внутрисосудистое давление; 2 – химизм кро ви; 3, 4 – дилататорные и констрикторные нервные волок на; 5 – тканевые метаболизмы
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
38 |
Глава 2. ФИЗИОЛОГИЯ СЕРДЕЧНО#СОСУДИСТОЙ СИСТЕМЫ. ПРИНЦИПЫ РЕГУЛЯЦИИ... |
Активные ответы являются при этом свойством расположенных в сосудистой стенке гладкомышечных элементов (миогенная регуляция).
3.Химические влияния (гуморальная регуляция): а) факторы, действующие снаружи на сосуд и представляющие собой, в основном, тканевые метаболиты (метаболическая регуляция); б) факторы, находящиеся в циркулирующей крови (гормональная регуляция).
Перечисленные виды регуляции, одни из которых являются дистанционными, а другие – местными, в сумме формируют изменения гидродинамического сопротивления того или иного отдела сосудистой системы, определяющие скорость и объем кровотока через данный сосудистый бассейн.
Нейрогенный контур регуляции тонуса сосудов
Отношение к нейрогенной регуляции сосудистого тонуса претерпело ряд изменений от признания ее ведущим механизмом в регуляции кровообращения до полного отрицания. Экспериментальный материал показывает, что нейрогенное управление обладает широкими возможностями как для централизованных, так и для местных перестроек кровообращения. Очень важно то, что нервный контур регуляции обладает максимальными скоростными возможностями распространения нервного импульса в центральный аппарат регулирования и в передаче сигнала на исполнительный механизм [12].
Важная роль в регуляции тонуса сосудов принадлежит адренергическим сосудосуживающим волокнам, которые оказывают эффект, высвобождая норадреналин лишь в непосредственном контакте с наружной поверхностью медии сосуда. При этом норадреналин связывается с α -рецепторами в мембране мышечной клетки и вызывает сокращение гладкой мышцы сосудистой стенки [3].
Нейрогенная вазодилатация несет очевидную нутритивную функцию, причем основным типом реакции признается пассивное расширение сосудов, возникающее при понижении активности вазоконстрикторных нервов.
Холинергические симпатические сосудорасширяющие нервы иннервируют более крупные прекапиллярные сосуды сопротивления скелетной мускулатуры. Поток сосудорасширяющих импульсов, поступающих к сосудам мышц, сопровождается интенсивным разрядом других симпатических нервов, увеличивающих частоту и силу сердечных сокращений и обеспечивающих сужение сосудов практически всех остальных регионарных сетей, за исключением головного мозга и миокарда. В результате этого кровоснабжение мышц может достигать почти максимального уровня.
В анализе перераспределения кровотока важен вопрос о реципрокных соотношениях симпатического вазомоторного тонуса в различных эфферентных сосудистых нервах (возбуждение в одних ветвях и торможение
в других), которые ведут к регионарному распределению сердечного выброса.
Любопытно, что в некоторых ситуациях, например, при физической нагрузке, в работающей ткани снижается чувствительность к вазоконстрикторным воздействиям нейрогенного происхождения – так называемый
функциональный симпатолиз. Принято считать, что механизм данного явления заключается в том, что продукты, выделяющиеся в процессе жизнедеятельности ткани, являются ингибиторами секреции констрикторных симпатических медиаторов. Следовательно, местные механизмы регуляции кровообращения могут подавлять центральные нейрогенные влияния [12].
Таким образом, нейрогенный контур регуляции способен осуществлять общий циркуляторный гомеостаз организма, обеспечивать независимость органного кровотока при резких системных сдвигах гемодинамики и, наконец, осуществлять перестройку распределения кровотока в тех или иных экстремальных ситуациях, отдавая преимущество наиболее жизненно важным органам
– головному мозгу и миокарду.
Механические факторы регуляции сосудистого тонуса
Активные сократительные реакции кровеносных сосудов инициируют две основные механические силы – внутрисосудистое давление и скорость потока крови. О первой силе известно давно, ее важная роль в регуляции кровообращения хорошо установлена; убедительные данные о возникновении активных реакций сосудистых гладких мышц в ответ на изменения сдвигов усилия, создаваемого потоком крови, получены лишь в 70-х годах [59].
В соответствии с феноменом Остроумова-Бейлис- са [60], повышение внутрисосудистого (трансмурального) давления ведет к растяжению гладких мышц сосудов, что возбуждает их активную сократительную реакцию, а это в свою очередь вызывает уменьшение диаметра сосуда. В результате происходит увеличение сопротивления потоку крови и сохранение кровотока неизменным, либо ограничение степени увеличения кровотока, сопровождающего повышение давления. Обратный эффект – расслабление гладких мышц, увеличение диаметра сосудов, снижение сосудистого сопротивления и увеличение или поддержание неизменным кровотока произойдет при снижении трансмурального давления. Изложенные представления отражают суть «миогенной гипотезы ауторегуляции кровотока» [7]. Этот миогенный контур регуляции не требует участия ЦНС и может принимать участие в регуляции кровообращения как на системном и органном, так и на тканевом уровнях.
Феномен расслабления сосудистых гладких мышц и увеличение диаметра сосудов в ответ на увеличе- ние скорости потока крови был продемонстрирован
2.2. Контуры регуляции тонуса сосудов |
39 |
впервые в эксперименте на артериальных сосудах гладких мышц, а затем подтвержден в опытах на сонной, почечной, коронарной, кишечной артериях. Поэтому предполагается, что способность сосудов менять свой просвет в соответствии со скоростью кровотока является общим свойством артериальных сосудов [59]. Показана высокая чувствительность сосудов к изменению скорости кровотока и устой- чивость эффекта. Увеличение диаметра сосудов сохраняется в течение всего времени поддержания повышенного кровотока. Деэндотелизация сосудов предотвращает возникновение этого феномена [7]. Не исключено, что увеличение диаметра артерии при механической стимуляции повышенным кровотоком обусловлено специфической функцией сосудистого эндотелия. К этому вопросу мы еще вернемся.
Химический контур регуляции тонуса сосудов
Формирование представлений о так называемом метаболическом механизме регуляции тканевого кровотока принято связывать с известной работой W. Gaskell (1880), в которой экспериментально была установлена роль продуктов тканевого обмена в развитии местных сосудистых реакций [61]. Примерно в те же годы L. Severini высказал гипотезу о непосредственном влиянии изменений содержания кислорода и углекислоты в крови на просвет сосудов [62].
Дальнейшая история исследований местной регуляции сосудистого тонуса свидетельствует о том, что попытки придать влиянию какого-либо одного фактора определяющую роль в механизмах такой регуляции, как правило, оказывались несостоятельными. В последние годы признание приобрела точка зрения о многофакторности местного управления тканевого кровотока.
Различают два вида химической регуляции сосудистого тонуса:
1)вазоактивными продуктами жизнедеятельности тканей (метаболическая регуляция);
2)продуктами, выделяемыми в кровяное русло специализированными структурно-функциональными образованиями (гормональная регуляция).
Ïîä метаболическими факторами регуляции тону-
са кровеносных сосудов подразумеваются химические вещества, накапливающиеся в межклеточной среде тканей и снаружи оказывающие влияние на гладкие мышцы близлежащих сосудов.
Среди нормальных продуктов метаболизма всех органов выраженным вазомоторным эффектом обладает двуокись углерода (ÑÎ2) – конечный продукт окислительного метаболизма. В большинстве органов и тканей увеличение уровня СО2 вызывает артериальную вазодилатацию, а снижение – вазоконстрикцию. Вазомоторный эффект СО2 существенно различается в разных органах. Он менее выражен в сосудах кожи, скелетных мышц, миокарда, но на со-
суды мозга СО2 оказывает мощное сосудорасширяющее действие [63]. При сильной произвольной гипервентиляции снижение уровня СО2 в крови приводит к столь выраженному сужению мозговых сосудов, что церебральный кровоток может уменьшиться вдвое [7].
Дилататорным влиянием на сосуды обладают молоч- ная кислота (лактат) и органические кислоты цикла Кребса. Увеличение их концентрации наблюдается при гипоксии, при ишемии тканей, а также в работающих скелетных мышцах; однако чувствительность сосудов к этим веществам невелика.
Увеличение концентрации водородных ионов (снижение рН) вне зависимости от конкретной причины вызывает расслабление сосудов скелетных мышц, почек, сердца, мозга; увеличение рН среды ведет к их сокращению. Наибольшей чувствительностью к изменениям рН обладают, очевидно, сосуды мозга [63, 64].
Одним из наиболее мощных дилататорных метаболитов является аденозин. Он образуется в тканях при гидролизе аденозинмонофосфата* и в органах с высокой функциональной активностью, например, в сердце, постоянно присутствует в условиях относительного покоя, причем тканевая концентрация аденозина в миокарде хорошо коррелирует с величиной коронарного кровотока [63]. Внутриартериальное введение аденозина вызывает зависимое от дозы расслабление сосудов и увеличение кровотока в скелетных мышцах, печени, почках, но наиболее резкое – в сердце [7, 64].
Из неорганических ионов наибольшее влияние на сосудистый тонус оказывают кальций è калий. Нали- чие ионов кальция в периваскулярной среде – необходимое условие для проявления нормальных сократительных реакций сосудов. Снижение интерстициальной концентрации ионов кальция приводит к расслаблению сосудистых гладких мышц, а повышение концентрации – к их сокращению.
Большое значение имеют ионы калия, выделяющиеся из клеток в интерстиций при усилении функциональной активности органов. Ионы калия вызывают расслабление сосудов; этот эффект слабо выражен в коронарном русле [63], сильно – в мозговых сосудах [64] и наиболее сильно – в сосудах скелетных мышц [7].
Один из важнейших факторов регуляции сосудистого тонуса – напряжение кислорода в крови и тканях. Дефицит кислорода возникает каждый раз, когда потребность в нем превышает его доставку [14]. Такие ситуации наблюдаются при увеличении функциональной активности тканей, при недостаточном кровоснабжении или при снижении напряжения кислорода в крови. В любом случае недостаток кислорода вызывает снижение сосудистого тонуса и увеличение кровотока, что направлено на ликвидацию дефицита кислорода. Надо под- черкнуть, что речь здесь идет только о местном влиянии дефицита кислорода без учета сопутствующих гипоксии хеморефлекторных, гормональных и других влия-
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
