
5 курс / Госпитальная педиатрия / Хоффман,_Кампс_Лечение_ВИЧ_инфекции,_2009
.pdf
1 Базовые сведения
ваны ключевые для этого процесса аминокислотные последовательности, усилия были направлены на синтез пептидов, способных связываться с доменами gp41 и вызывающих конформационные изменения, тем самым предотвращающих слияние внешней оболочки вируса с клеточной мембраной.
T-20 первым из пептидов, связывающихся с gp41, прошел клинические испытания, в которых оценивалась эффективность подавления репликации вируса (см. главу 6 «АРТ в 2009 году»). В настоящее время Т-20 уже используется для лечения пациентов с симптоматическим течением ВИЧ-инфекции. К недостаткам препарата относится невозможность приема внутрь; препарат вводится подкожно два раза в сутки.
С помощью трансфекций клеточных линий были выявлены и другие хемокиновые рецепторы, которые наряду с CCR5 и CXCR4 служат корецепторами для некоторых штаммов ВИЧ — CCR3, CCR2, CCR8, CCR9, STRL33 («Bonzo»), Gpr 15 («Bob»), Gpr 1, APJ и ChemR23 (Deng, 1997; Liao, 1997). ВИЧ-1, возможно, также способен связываться с некоторыми интегринами, например, 4 7, нарушая функции клеток и процессы миграции (Arthos, 2008). По некоторым данным, APJ служит корецептором ВИЧ для проникновения в клетки ЦНС. Несмотря на широкий спектр молекул, которые потенциально могут стать корецепторами для ВИЧ-1, основную роль in vivo, по-видимому, играют CCR5 и CXCR4.
Важность CCR5 как основного корецептора для M-тропных штаммов ВИЧ становится видна из следующего наблюдения: большинство людей с дефектным геном CCR5 не восприимчивы к ВИЧ-1 (Liu, 1996). Эксперименты in vitro показали, что выделенные из крови этих людей T-лимфоциты устойчивы к M-тропным штаммам ВИЧ-1, но остаются восприимчивыми к T-тропным штаммам. У таких людей лимфоциты не экспрессируют на своей поверхности рецептор CCR5 вследствие делеции (утери) 32 пар нуклеотидов в гене CCR5. Во всем мире известно лишь несколько случаев ВИЧ-1-инфекции у людей, гомозиготных по делеции гена CCR5. Неудивительно, что все они были инфицированы T-тропными штаммами ВИЧ-1, использующими для проникновения в клетку корецептор CXCR4. Эпидемиологические исследования показали, что 10-20% лиц европеоидной расы гетерозиготны по мутантному аллелю гена CCR5 (доля гетерозиготных лиц выше среди выходцев из стран Северной Европы), а гомозиготны — около 1% лиц европеоидной расы (Dean, 1996). У жителей Африки и Азии такой делеции гена CCR5 не обнаружено; это говорит о том, что данная мутация возникла уже после разделения человечества на расы в процессе эволюции.
У лиц, гетерозиготных по делеции 32 пар нуклеотидов в гене CCR5, снижена экспрессия рецептора CCR5 на поверхности клеток; они намного чаще встречаются среди лиц с длительным непрогрессирующим течением болезни, нежели среди лиц с быстрым прогрессированием ВИЧ-инфекции (Dean, 1996). Кроме того, у ВИЧ-инфицированных лиц, гетерозиготных по делеции 32 пар нуклеотидов в гене CCR5, переход в стадию СПИДа происходит медленнее, лучше ответ на ВААРТ и меньше заболеваемость лимфомами. Это говорит о том, что плотность рецепторов CCR5 на поверхности клетки влияет на скорость репликации ВИЧ не только in vitro, но и in vivo.
Помимо делеции 32 пар оснований гена CCR5 были описаны и другие генетические полиморфизмы рецепторов хемокинов (CCR2) и их промоторов (CCR5), которые влияли на скорость прогрессирования ВИЧ-инфекции. В зависимости от распространенности этих полиморфизмов среди пациентов со сходным течением ВИЧ-инфекции, они распределяются на способствующие более быстрому или более благоприятному течению ВИЧ-инфекции (Anzala, 1998; Winkler, 1998). Недавние исследования пролили свет на влияние CCL3L1-CCR5 генотипа не только не прогрессирование ВИЧ-инфекции, но также на ответ на антиретровирусную терапию (Ahuja, 2008). По-видимому, это зависит не от механизма проникновения ВИЧ в клетку, а от эффективности клеточно-опосредованного иммунного ответа (Dolan, 2007).
У больных с быстрым прогрессированием инфекции (быстрым падением количества лимфоцитов CD4) штаммы, использующие CXCR4 в качестве основного корецептора, выделяются чаще, чем у больных со стабильным количеством лимфоцитов CD4. Экспрессия корецепторов на лимфоцитах CD4 зависит от уровня активации этих клеток.
50
Рецептор CXCR4 экспрессируется преимущественно на «наивных» T-лимфоцитах, а рецептор CCR5 — на активированных T-лимфоцитах, клетках памяти и эффекторных Т-лимфоцитах. На ранней стадии ВИЧ-1-инфекции преобладают M-тропные штаммы ВИЧ. Примечательно, что M-тропные штаммы ВИЧ передаются чаще независимо от того, какие штаммы — T-троп- ные или M-тропные — преобладают у источника инфекции. Пока неясно, обусловлено это избирательным транспортом M-тропных штаммов дендритными клетками подслизистого слоя или благоприятным содержанием хемокинов и цитокинов в окружающей среде для размножения M-тропных вирусов. Привлекает внимание гипотеза о том, что благодаря размножению в макрофагах M-тропным вирусам легче ускользнуть от иммунной системы, чем T-тропным, что дает им преимущество в выживании.
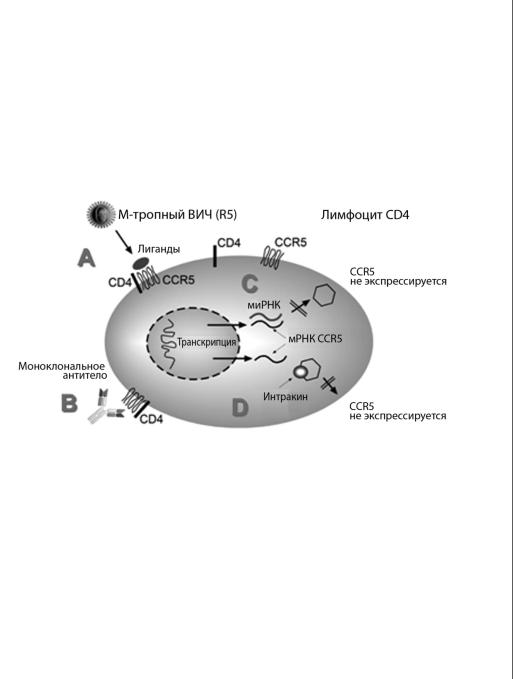
В связи с этим блокада рецепторов CCR5 представляется перспективным направлением в лечении ВИЧ-инфекции (рис. 3.5). Моноклональные антитела к CCR5 (2D7 и другие) in vitro способны блокировать проникновение штаммов, использующих CCR5 в качестве корецептора, в лимфоциты CD4 и макрофаги. Уже созданы низкомолекулярные блокаторы рецепторов CCR5; в ходе предварительных клинических испытаний (см. главу 6 «АРТ в 2009 году») было продемонстрировано статистически значимое уменьшение вирусной нагрузки в плазме ВИЧ-инфи- цированных (Fätkenheuer, 2005). Однако результаты исследований in vitro, а также экспериментов на мышах линии SCID (severe combined immunodeficiency [тяжелый комбинированный иммунодефицит]), показали, что подавление штаммов ВИЧ, использующих корецепторы CCR5, может приводить к изменению их тропности в сторону корецепторов CXCR4 (De Clercq, 2001).
Рис 3.5. Технологии защиты клетки от проникновения CCR5-тропного ВИЧ. Блокада корецепторов CCR5 на поверхности клетки лигандами, которые не являются агонистами (A) или моноклональными антителами (B). Второй путь — уменьшение экспрессии корецептора CCR5 на поверхности клетки с помощью миРНК или интракинов. Подробнее см. в тексте
Низкомолекулярные блокаторы, в том числе T-22, ALX40-4C и AMD3100, способны блокировать рецепторы CXCR4 (см. главу 6 «АРТ в 2009 году») и в настоящее время проходят доклинические и клинические испытания. Эффективность других блокаторов CCR5 в лекарственных формах для нанесения на слизистые оболочки изучалась на обезьяньих моделях и, возможно, в будущем такие препараты войдут в арсенал средств для профилактики заражения ВИЧ (Veazey, 2005).
Сегодня разрабатываются методы модулирования экспрессии хемокиновых рецепторов. Интракины — это хемокины, которые находятся в цитоплазме и способны связываться со своими рецепторами еще во время транспортировки рецептора к поверхности клетки (Chen, 1997). «Малые интерферирующие РНК» (миРНК) представляют собой новый молекулярный инстру-
51
1 3. Патогенез ВИЧ-1-инфекции

1 Базовые сведения
мент селективной инактивации генов-мишеней. Двухцепочечная РНК расщепляется ферментом dicer-1 на короткие части («21-23-меры»). Эти олигомеры могут комплементарно связываться с длинными последовательностями РНК, после чего последние распадаются. Такая технология в настоящее время применяется в растениеводстве для защиты растений от вирусов. In vitro миРНК против CCR5 способны предотвратить экспрессию CCR5, а инактивация гена gag может эффективно блокировать репликацию ВИЧ (Song, 2005).
Хотя применение блокаторов хемокиновых рецепторов кажется перспективным направлением в лечении ВИЧ-инфекции, немало вопросов еще остаются открытыми. Эксперименты на мышах с инактивированными генами CXCR4 или SDF-1 выявили тяжелые нарушения кроветворения и развития мозжечка (Zou, 1997). Пока неясно, может ли блокада рецепторов CXCR4 привести к нарушениям со стороны каких-либо органов или систем у детей или взрослых.
2.2. События после проникновения вируса в клетку
После слияния наружной оболочки вируса с клеточной мембраной вирусное ядро высвобождается в цитоплазму клетки-мишени. Недавно были получены новые сведения о том, как происходят эти «ранние события». ВИЧ способен проникать в лимфоциты макак-резусов, но до начала процесса обратной транскрипции или вскоре после него репликация вируса прекращается. Эта внутриклеточная блокада опосредована клеточным фактором TRIM5α, который является компонентом цитоплазматических телец, чья основная функция пока не установлена. Молекулы TRIM5α, выделенные от животных разных видов, проявляют определенную специфичность в отношении взаимодействия с ретровирусами. Например, TRIM5α макак-резусов (TRIM5α rh) сильнее подавляет репликацию ВИЧ, чем TRIM5α человека, в то время как вирус иммунодефицита обезьян, который в естественных условиях патогенен для низших узконосых обезьян (Cercopithecidae), менее чувствителен к любым формам TRIM5α, чем ВИЧ. Отчасти это объясняет видовую специфичность ВИЧ к клеткам человека (Stremlau 2004). TRIM5α клеток человека и других приматов способен подавлять репликацию других лентивирусов и представляет собой недавно открытый фактор клеточной защиты, биологическое значение которого до конца не ясно. Пока не установлено, как именно TRIM5α блокирует обратную транскрипцию; предполагается, что TRIM5α взаимодействует с капсидным белком проникающего в клетку вируса, присоединяя к нему «метки» из мономеров убиквитина для последующего направленного разрушения протеазами.
Проникновение ВИЧ в покоящиеся Т-лимфоциты происходит таким же образом, как проникновение в активированные T-лимфоциты, однако в покоящихся клетках не завершается синтез
Рис. 3.6. Жизненный цикл ВИЧ
52

провирусной ДНК (Zack, 1990). Синтез провирусной ДНК на матрице вирусной РНК в цитоплазме клетки под действием фермента обратной транскриптазы — это ключевой момент процесса репликации ВИЧ (рис. 3.6). Блокирование обратной транскриптазы нуклеозидным ингибитором зидовудином было первой попыткой подавить размножение вируса у ВИЧ-1-инфицированных. Начиная с середины 80-х годов арсенал препаратов, относящихся к ингибиторам обратной транскриптазы, значительно пополнился, и сегодня в клинической практике применяются нуклеозидные, нуклеотидные и ненуклеозидные ингибиторы обратной транскриптазы.
Обратная транскрипция происходит в несколько этапов. После связывания праймеров тРНК в участке PBS(primer binding site [участок связывания праймера]) начинается синтез минус-цепи провирусной ДНК, который завершается на 5’-концевом повторе с образованием короткой цепи ДНК R-U5. Следующий этап — расщепление РНК выше участка PBS вирусным ферментом РНКазой H и сдвиг рамки ДНК R-U5 с гибридизацией в области R-участка на 3’-концевом участке РНК. После этого завершается синтез полноразмерной провирусной ДНК с последующим расщеплением тРНК. В результате обратной транскрипции образуется двойная цепь ДНК ВИЧ с длинными концевыми повторами (LTR) на каждом конце.
В покоящихся T-лимфоцитах образованная в результате обратной транскрипции провирусная ДНК не встраивается в геном клетки хозяина. Для того чтобы клеточная ДНК встроилась в ДНК клетки-хозяина, необходима активация клетки и перемещение вирусного преинтеграционного комплекса из цитоплазмы в ядро. In vitro активация клеток происходит, например, после стимуляции антигенами или митогенами, in vivo активация иммунной системы наблюдается после контакта с антигеном, вакцинации или на фоне оппортунистической инфекции. Кроме того, получены доказательства, что ВИЧ-1 способен самостоятельно активировать зараженные клетки с помощью гликопротеина gp120. обеспечивая встраивание провирусной ДНК в клеточный геном. Помимо моноцитов, макрофагов и клеток микроглии, латентно инфицированные покоящиеся лимфоциты CD4, в цитоплазме которых содержится не встроенная
вклеточный геном провирусная ДНК ВИЧ, представляют собой клеточные резервуары ВИЧ,
вкоторых вирус сохраняется длительное время (Chun, 1997), а клеточные микроРНК способствуют сохранению вируса в латентном состоянии в покоящихся первичных лимфоцитах CD4 (Huang, 2007). Поскольку естественное течение ВИЧ-1-инфекции характеризуется постоянной репликацией вируса в активированных лимфоцитах CD4, пребывание вируса в латентном состоянии в покоящихся лимфоцитах CD4 скорее всего является случайным феноменом, не имеющим большого значения в патогенезе этой инфекции. Однако этот небольшой резервуар латентного провируса приобретает особое значение с началом ВААРТ: антивирусные препараты не действуют на нереплицирующиеся провирусы, поэтому ВИЧ, сохраняющий способность к размножению, продолжает персистировать в этих клетках и способен проявиться новым всплеском виремии при отмене препаратов. Именно существование этого резервуара латентного вируса не позволяет добиться полного устранения (элиминации) вируса у ВИЧ-инфицированных с помощью ВААРТ (Chun, 2005).
Лишь недавно стало ясно, почему ВИЧ плохо реплицируется в покоящихся лимфоцитах CD4. Клеточный белок Murr1, участвующий в метаболизме меди, способен подавлять репликацию ВИЧ-1 в нестимулированных лимфоцитах CD4. Белок Murr1 был обнаружен в первичных покоящихся лимфоцитах CD4, в которых он подавляет активацию фактора транскрипции NF-κB, блокируя деградацию ингибиторного белка IκBα. IκBα препятствует перемещению NF-κB в ядро, особенно после цитокиновой стимуляции (например, воздействия ФНОα). Поскольку область LTR ВИЧ содержат множество участков связывания NF-κB, предотвращение миграции NF-κB в ядро должно подавлять репликацию ВИЧ. Ингибирование Murr-1 с помощью миРНК приводит к репликации ВИЧ в покоящихся лимфоцитах CD4 (Ganesh, 2003). Персистирование ВИЧ в покоящихся лимфоцитах CD4 и других клетках-резервуарах считается основной причиной невозможности полной элиминации вируса. Если это в принципе достижимо, получение подробных сведений о том, как и когда появляются клеточные резервуары ВИЧ и как на них можно воздействовать, имеет первостепенное значение для разработки направлений лечения, нацеленных на полное устранение инфекции.
53
1 3. Патогенез ВИЧ-1-инфекции

1 Базовые сведения
Клеточные факторы транскрипции, в частности NF-κB, также могут связываться с областью LTR ВИЧ. После стимуляции митогенами или цитокинами фактор NF-κB транслоцируется в ядро, где связывается с областью LTR ВИЧ, запуская транскрипцию вирусных генов. В результате транскрипции сначала синтезируются регуляторные вирусные белки, в частности Tat и Rev. В ядре клетки белок Tat связывается с трансактивируемым регуляторным элементом (transacti- vation-response element, TAR), расположенным в начале вирусной РНК, и стимулирует транскрипцию и образование длинных транскриптов РНК. Белок Rev стимулирует экспрессию генов, отвечающих за синтез структурных белков и ферментов, и подавляет продукцию регуляторных белков, тем самым обеспечивая образование зрелых вирусных частиц. Белки, кодируемые генами pol и gag, образуют вирусный капсид; продукты гена env образуют поверхностный гликопротеин gp120 — «шипы» внешней оболочки вируса. Гликопротеин gp120 образуется в результате расщепления вирусной протеазой своего предшественника — гликопротеина gp160 — на gp120 и gp41. Продукты гена gag также образуются в результате расщепления протеазой ВИЧ белка-предшественника массой 53 кДа на белки p24, p17, p9 и p7. Поскольку расщепление мо- лекул–предшественников протеазой ВИЧ — необходимое условие для образования новых полноценных вирусных частиц, этот фермент служит еще одной мишенью для антиретровирусной терапии. Сборка вирусов происходит поэтапно: из вирусной РНК, белков Gag и ферментов Pol образуется нуклеокапсид, который перемещается к клеточной мембране. Крупные молекулыпредшественники расщепляются вирусной протеазой, после чего завершается сборка зрелых вирусов и они отпочковываются от клетки. При отпочковывании в липидную оболочку вируса могут встраиваться различные белки клетки-хозяина, некоторые фосфолипиды и молекулы холестерина. В отличие от T-лимфоцитов, в которых отпочковывание происходит на поверхности клеток и приводит к выделению вирусов в межклеточное пространство, в моноцитах и макрофагах процесс завершается накоплением вируса внутри клеточных вакуолей.
Репликация ретровирусов происходит с ошибками и характеризуется высокой частотой спонтанных мутаций. В среднем при обратной транскрипции происходит от 1 до 10 ошибок на один геном или на один цикл репликации. Мутации могут приводить к образованию вирионов со сниженной способностью к репликации. С другой стороны, могут появляться и накапливаться мутации, в результате которых вирус приобретает устойчивость к антивирусным препаратам. На фоне селективного воздействия антиретровирусных препаратов при условии неполного подавления репликации вируса в организме ВИЧ-инфицированного начинают преобладать вирусы, резистентные к препаратам.
Кроме того, для ВИЧ характерна высокая скорость репликации и большой «оборот» вирусных частиц: в среднем за сутки образуется и погибает 1 миллиард вирусных частиц. Вследствие высокой скорости размножения вируса и большой частоты мутаций в организме ВИЧ-инфици- рованного накапливается множество близких вариантов вируса, так называемых «псевдовидов» или «квазивидов» (quasispecies). Преимущество в выживании получают псевдовиды, приобретшие в результате мутаций устойчивость не только к антиретровирусным препаратам, но и к факторам иммунной защиты, таким как нейтрализующие антитела и цитотоксические T-лимфо- циты (ЦТЛ).
3. ВИЧ и иммунная система
3.1. Роль антигенпредставляющих клеток в патогенезе ВИЧ-инфекции
Дендритные клетки как антигенпредставляющие клетки
К основным антигенпредставляющим клеткам иммунной системы относятся дендритные клетки (ДК), макрофаги и В-клетки. Дендритные клетки являются наиболее мощными индукторами специфического иммунного ответа и играют главную роль в инициации первичных ан- тиген-специфических иммунных реакций. Предшественники дендритных клеток мигрируют из костного мозга в первичные лимфоидные органы и подслизистый слой кишечника, мочеполовой и дыхательной систем. Они способны захватывать и перерабатывать растворимые антигены и мигрировать во вторичные лимфоидные органы, где активируют антиген-специфи-
54

ческие T-лимфоциты. Поскольку дендритные клетки играют важную роль в адаптивном иммунном ответе, в настоящее время изучаются возможности их применения для стимуляции образования ВИЧ-специфических Т-лимфоцитов или увеличения их количества. Дендритные клетки, полученные от ВИЧ-инфицированных, очищаются, инкубируются с инактивированными (неинфекционными) вирионами ВИЧ и затем используются для вакцинации (Lu, 2004).
Дендритные клетки — это гетерогенная популяция клеток с различными функциональными возможностями и экспрессируемыми фенотипическими маркерами в зависимости от микроокружения и степени зрелости. Незрелые дендритные клетки могут захватывать и перерабатывать чужеродные антигены, но их способность активировать T-лимфоциты слаба. Зрелые дендритные клетки, напротив, обладают в основном иммуностимулирующей активностью. У тканевых дендритных клеток и клеток Лангерганса (специализированных клеток кожи и слизистых) более незрелый фенотип, и они могут захватывать антигены. После захвата антигена они мигрируют в лимфоидную ткань, где созревают. Взаимодействие вирусов с толл-подоб- ными рецепторами (toll-like receptors, TLR) плазмацитоидных дендритных клеток вызывает интенсивную выработку интерферона альфа, обладающего противовирусной активностью. Так возникает связь между системами врожденного и приобретенного (адаптивного) иммунного ответа и, возможно, этот механизм играет определенную роль в патогенезе ВИЧ-инфекции (Mandl, 2008).
Для стимуляции лимфоцитов CD8 и образования антиген-специфических цитотоксических T-лимфоцитов (ЦТЛ) необходимо представление пептидного антигена в комплексе с HLA (MHC) класса I. Дендритные клетки могут инфицироваться вирусами, например вирусом гриппа. При этом в цитоплазме клетки наряду с клеточными белками синтезируются вирусные белки, которые расщепляются на пептиды и переносятся в цитозоль эндоплазматического ретикулума, где связываются с HLA (MHC) класса I. Образовавшийся комплекс перемещается на поверхность дендритной клетки. Дендритная клетка также может забирать чужеродные антигены с поверхности инфицированных клеток для последующего представления в комплексе с HLA (MHC) класса I (Maranon, 2004). Примечательно, что эффективность представления вирусного антигена не зависит от того, заражена ли вирусом сама дендритная клетка.
Число комплексов специфический пептидный антиген — HLA (MHC) класса I обычно ограничено, и этот комплекс распознается лишь одним клоном T-лимфоцитов из 100 000 и более. Антигенраспознающие рецепторы T-лимфоцитов (TCR) обладают низкой аффинностью к антигену (не более 1 mM). Однако высокая плотность дополнительных стимулирующих молекул на поверхности дендритных клеток позволяет усилить взаимодействие антигенраспознающих рецепторов с комплексами пептидный антиген — HLA (MHC) класса I и через активацию сигнальной системы клетки инициировать пролиферацию (клональную экспансию) T-лимфоцитов. Зараженные вирусом или опухолевые клетки зачастую не экспрессируют на своей поверхности дополнительных стимулирующих молекул и поэтому не способны вызывать клональную экспансию эффекторных клеток. Это лишний раз подчеркивает важность высокоспециализированной системы антигенпредставляющих клеток (в том числе дендритных) для инициации T-клеточного ответа.
Взаимодействие дендритных клеток с B- и T-лимфоцитами
Главные эффекторные клетки антиген-специфического иммунного ответа — B- и T-лимфо- циты. Однако их функция регулируется дендритными клетками. Дендритные клетки способны захватывать антигены на периферии, перерабатывать их и представлять на своей поверхности в комплексе с дополнительными стимулирующими молекулами, запускающими процесс активации Т-лимфоцитов. B-лимфоциты могут распознавать антиген после его связывания с антигенраспознающим рецептором на поверхности B-лимфоцита. Распознавание антигена T-лим- фоцитами возможно только после предварительной переработки и представления пептидных фрагментов антигена дендритными клетками. T-лимфоциты экспрессируют на своей поверхности различные антигенраспознающие рецепторы (TCR), которые могут связываться с пептидными фрагментами антигена на поверхности дендритных клеток, при этом комплекс пептидный антиген — HLA (MHC) класса I активирует T-лимфоциты CD8, а комплекс пептидный
55
1 3. Патогенез ВИЧ-1-инфекции

1 Базовые сведения
антиген —HLA класса II — T-лимфоциты CD4. Способность дендритных клеток активировать T-лимфоциты зависит также от секреции стимулирующих цитокинов, в том числе ИЛ-12 — ключевого цитокина, регулирующего процессы образования и активации T-хелперов 1-го типа и натуральных киллеров (НК).
Для стимуляции мощного антиген-специфического T-клеточного ответа достаточно небольшого числа дендритных клеток и небольшого количества антигена, что свидетельствует о высокой иммуностимулирующей способности дендритных клеток. Экспрессия молекул адгезии
илектинов (в частности DC-SIGN) способствует агрегации дендритных клеток и T-лимфоци- тов и усиливает взаимодействие с антигенраспознающими рецепторами T-лимфоцитов. DCSIGN — это лектин типа C, который связывается с лентивирусами (в том числе с вирусом иммунодефицита обезьян, ВИЧ-1 и ВИЧ-2) посредством взаимодействия с олигосахаридными участками gp120 (Geijtenbeek, 2000). DC-SIGN способен также связываться с микобактериями
ивирусом денге. Иммуногистохимические исследования in vivo показали, что DC-SIGN экспрессируется на дендритных клетках подслизистого слоя и кожи. Полагают, что DC-SIGN играет определенную роль в заражении ВИЧ через слизистые и при вертикальной передаче инфекции. Было показано, что экспрессия DC-SIGN способствует проникновению ВИЧ в T-лимфоциты и повышает эффективность использования корецепторов, если их экспрессия ограничена. Таким образом, DC-SIGN может оказаться тем средством, с помощью которого ВИЧ-1 проникает в дендритные клетки слизистых оболочек. Зараженные дендритные клетки мигрируют в лимфоидную ткань, где ВИЧ-1 передается всем находящимся там лимфоцитам CD4 (Lore, 2005).
3.2. Репликация вируса в лимфоидной ткани
Репликация вируса в лимфоидной ткани крайне интенсивна на ранних стадиях инфекции (Embretson, 2003; Pantaleo, 1993).
Во время начальной фазы ВИЧ-1-инфекции происходит мощный выброс вирусных частиц в плазму («всплеск» виремии), за которым следует постепенное снижение концентрации вируса в крови. В этот период появляется большое количество ВИЧ-1-специфичных цитотоксических T-лимфоцитов, что у большинства пациентов сопровождается ранним снижением концентрации вируса в крови. В лимфоидной ткани вирусы захватываются сетью фолликулярных дендритных клеток (ФДК). Главная мишень вируса — макрофаги и лимфоциты CD4, как активированные, так и покоящиеся. Уже на ранних стадиях инфекции формируются постоянные резервуары вируса, главным образом в макрофагах и латентно инфицированных покоящихся Т-лимфоцитах. Наличие таких латентных резервуаров служит главным препятствием, не позволяющим добиться полной элиминации вируса. На всем протяжении ВИЧ-1-инфекции лимфоидная ткань служит основным местом репликации ВИЧ. В лимфоидной ткани доля клеток, содержащих провирусную ДНК, в 5-10 раз выше, чем среди циркулирующих в крови мононуклеаров, а репликация ВИЧ-1 в лимфоидной ткани на 1-2 порядка выше, чем в крови.
После проникновения ВИЧ-1 в покоящийся лимфоцит CD4 и завершения обратной транскрипции, вирусный геном представлен провирусной невстроенной ДНК ВИЧ-1. В экспериментах in vitro было показано, что ВИЧ-1 встраивается преимущественно в активные гены («горячие точки») (Schroder, 2002). Таким образом, для встраивания провирусной ДНК в геном клетки-хозяина и, следовательно, для образования новых вирусных частиц, необходима активация T-лимфоцитов. Поэтому лимфоидная ткань служит наиболее благоприятной средой для репликации ВИЧ-1. Тесный контакт лимфоцитов CD4 и антигенпредставляющих клеток, наличие вирусов на поверхности фолликулярных дендритных клеток и изобилие провоспалительных цитокинов (в частности, ИЛ-1, ИЛ-6 и ФНОα) способствуют началу репликации ВИЧ-1 в инфицированных клетках и поддерживают ее в дальнейшем. Отметим, что ИЛ-1 и ФНОα индуцируют NF-kB, который связывается с областью LTR ВИЧ-1 и запускает транскрипцию провируса. На важность антигензависимой активации лимфоцитов CD4 указали результаты нескольких исследований in vivo и in vitro, в которых было обнаружено усиление репликации ВИЧ-1 на фоне вакцинации против столбняка или гриппа, а также на фоне туберкулезной инфекции (O’Brian, 1995). Хотя польза вакцинации против распространенных возбудителей (на-
56

пример, против гриппа или столбняка) у ВИЧ-1-инфицированных перевешивает риск временного повышения вирусной нагрузки, результаты этих исследований свидетельствуют о том, что любая активация иммунной системы может сопровождаться повышением репликации ВИЧ.
На фоне ВААРТ в лимфоидной ткани значительно снижается количество T-лимфоцитов, в которых идет активная репликация вируса (Tenner-Racz, 1998). Однако, несмотря на успешное подавление виремии, у всех пациентов сохраняется пул покоящихся T-лимфоцитов с латентной формой вируса. Эти клетки способны дать новый всплеск вирусной репликации после отмены антивирусных препаратов.
При естественном течении ВИЧ-1-инфекции у большинства пациентов количество лимфоцитов CD4 постепенно снижается, в то время как концентрация ВИЧ-1 в крови постепенно растет. Если проводить гистологические исследования лимфоидной ткани на протяжении всего периода заболевания, то можно было бы увидеть, что прогрессирование инфекции сопряжено с разрушением архитектоники лимфоидной ткани и снижением захвата вирусных частиц. Различные иммуногистологические исследования показывают, что репликация ВИЧ начинается главным образом в паракортикальной зоне лимфоузлов (Embretson, 1993; Pantaleo, 1993). Заражение окружающих лимфоцитов CD4, а также их активация дендритными клетками способствуют распространению ВИЧ-1 по лимфоидной ткани. Как и при инфекции, вызванной вирусом иммунодефицита обезьян у макак-резусов, при ВИЧ-инфекции на всех ее стадиях процессы репликации вируса и разрушения лимфоцитов CD4 происходят намного активнее в собственной пластинке слизистой и подслизистой кишечника, чем в лимфоузлах (Veazey, 1998; Brenchley, 2004). Это обусловлено тем, что в кишечнике представлена основная популяция несущих рецептор CCR5 эффекторных клеток памяти CD4, которые служат лучшей мишенью для репликации ВИЧ по сравнению со смешанной популяцией лимфоцитов CD4 в лимфоузлах. Кроме того, белок Nef ВИЧ-1, по-видимому, утратил функцию, которая есть у вируса иммунодефицита обезьян — подавление экспрессии CD3 и Т-клеточного антигенраспознающего рецептора (TCR), что приводит к снижению уровня хронической активации клетки и, соответственно, ее восприимчивости к апоптозу (Schindler, 2006). Результаты нескольких исследований показали, что снижение количества CD4+CCR5+ клеток памяти в лимфоидной ткани подслизистого слоя в периоде острой инфекции характерны как для инфекции ВИЧ, так и для инфекции ВИО (SIV). На ранней стадии ВИО-инфекции до 60% всех лимфоцитов CD4, находящихся в собственной пластинке стенки кишечника, экспрессируют вирусную РНК. Большинство этих клеток разрушаются под воздействием прямых и непрямых факторов в течение нескольких дней. Дальнейшее прогрессирование заболевания, по-видимому, зависит главным образом от способности организма восстановить пул клеток памяти в лимфоидной ткани подслизистого слоя. Опираясь на эти сведения, некоторые исследователи считают, что начало АРТ на стадии острой ВИЧ-инфекции позволит уменьшить отдаленные последствия повреждения иммунной системы, происходящие на этой стадии.
Сегодня изучается также влияние ВИЧ-инфекции на тимус и его роль в снижении числа лимфоцитов CD4 и поддержании гомеостаза. Недавно полученные результаты позволили предположить, что образование в тимусе лимфоцитов CD4 на фоне ВИЧ-инфекции снижается, особенно у пациентов пожилого возраста, и что этот эффект связан с нарушениями процессов пролиферации T-лимфоцитов в тимусе; механизм этого остается неясным, поскольку тимоциты не экспрессируют CCR5 и не являются обычной мишенью для ВИЧ (Douek, 2001).
3.3. Система HLA и иммунный ответ на ВИЧ
Лимфоциты CD8 распознают «свой» антиген (пептидный фрагмент) в комплексе с молекулами HLA класса I на поверхности антигенпредставляющей клетки, а лимфоциты CD4 — в комплексе с молекулами HLA класса II. Таким образом, формирование специфического иммунного ответа на ВИЧ-1 зависит от индивидуального набора антигенов HLA.
На антигенпредставляющих клетках пептиды ВИЧ могут по-разному связываться с молекулами HLA класса I. В результате активация лимфоцитов CD8 может быть достаточной, недостаточной или вообще не произойти. В крупных когортных исследованиях были предприняты по-
57
1 3. Патогенез ВИЧ-1-инфекции

1 Базовые сведения
пытки найти зависимость между характером естественного течения ВИЧ-1-инфекции (быстрое или медленное прогрессирование) и определенными антигенами HLA. Связь между наличием определенных антигенов HLA и благоприятным течением инфекции прослеживалась примерно у 40% ВИЧ-1-инфицированных с длительным непрогрессирующим течением инфекции. Протективным фактором от прогрессирования ВИЧ признана гомозиготность по HLA-Bw4. У гетерозигот по локусам HLA класса I иммунодефицит развивается медленнее, чем у гомозигот (Carrington, 1999). Первое исследование Kaslow в 1996 г. показало, что у носителей HLA-B14, B27, B51, B57 и C8 инфекция прогрессирует медленнее, а у носителей HLA-A23, B37 и B49 иммунодефицит развивается быстро (Kaslow, 1996). У всех ВИЧ-1-инфицированных с HLA-B35 стадия СПИДа наступала через 8 лет после заражения. Результаты недавних исследований показали, что у половых партнеров, «не совпадающих» по HLA класса I, риск заражения ВИЧ при гетеросексуальных контактах ниже (Lockett, 2001).
Исследования in vitro обнаружили у носителей HLA-B57 специфичные к пептидам ВИЧ-1 ЦТЛ
сограниченной по HLA-B57 цитотоксичностью. Однако вполне возможно, что протективный эффект некоторых аллелей HLA или пептидов ВИЧ, определяющих ограниченную по HLA цитотоксичность, не обязательно найдет применение в создании профилактических вакцин. Kaul и соавт. обнаружили, что лимфоциты CD8 контактировавших с ВИЧ-1, но не заразившихся африканок и лимфоциты CD8 ВИЧ-инфицированных африканок распознавали разные эпитопы ВИЧ-1 (Kaul, 2001). Это свидетельствует о том, что эпитопы, на которые направлено действие иммунной системы во время борьбы с инфекцией, и эпитопы, необходимые для защиты от инфекции, могут не совпадать. Кроме того, индивидуальный набор антигенов HLA может влиять на приобретенный (адаптивный) иммунный ответ и развитие мутаций вируса, направленных на защиту от иммунной системы (Friedrich, 2004; Leslie, 2004). ЦТЛ, выделенные от пациентов
сHLA B57 и B58, могут привести к формированию у вируса определенных мутаций в гене gag, позволяющих вирусу уклоняться от атаки ЦТЛ, однако эти мутации снижают репликативную способность вируса и в результате вирусная нагрузка снижается (Goepfert, 2008). Если такой штамм вируса будет передан человеку с другим набором антигенов HLA, то при отсутствии селективного воздействия иммунной системы, обусловленного ЦТЛ, вирус может мутировать обратно до исходного генотипа с восстановлением полноценной способности к репликации.
Антигены HLA класса II играют ключевую роль в формировании ВИЧ-1-специфического клеточного иммунного ответа, опосредованного лимфоцитами CD4. Rosenberg в 1997 г. впервые обнаружил у лиц с длительным непрогрессирующим течением инфекции ВИЧ-1-специфичные лимфоциты CD4, способные к пролиферации в ответ на антигены ВИЧ. Зависимость характера течения ВИЧ-инфекции от присутствия определенных аллелей HLA класса II изучена в меньшей степени. В когортных исследованиях с участием перинатально инфицированных детей и ВИЧ-инфицированных взрослых протективный эффект обнаружен у HLA-DR13 (Keet, 1999).
Рецепторы KIR (killer cell immunoglobulin like receptors [рецепторы клеток-киллеров, содержащие иммуноглобулиноподобные домены]) представляют собой лиганды, которые связываются с антигенами HLA класса I и, действуя либо как ингибиторы, либо как активаторы, регулируют активацию NK-клеток. Обнаружены зависимости между наличием полиморфизмов генов KIR и медленным или быстрым прогрессированием ВИЧ-инфекции, особенно, если в анализ включали известные полиморфизмы HLA класса I (Fauci, 2005). Во время ВИЧ-1-инфекции может наблюдаться не только количественное уменьшение НК-клеток, но и снижение их цитолитической активности. Предварительные результаты исследований позволяют предположить, что при низком количестве НК-клеток ускоряется прогрессирование болезни.
В заключение следует сказать, что на сегодняшний день выявлены различные генетические полиморфизмы, оказывающие определенное влияние на течение ВИЧ-инфекции. Однако пока нет оснований для того, чтобы рекомендовать проведение генетических исследований всем ВИЧ-1-инфицированным или опираться на результаты генетических анализов при выборе тактики лечения.
58

3.4. ВИЧ-специфический клеточный иммунный ответ
Цитотоксические T-лимфоциты (ЦТЛ) способны распознавать и элиминировать инфицированные вирусом клетки. Результаты ряда исследований четко продемонстрировали, что цитотоксические T-лимфоциты играют ключевую роль в сдерживании репликации ВИЧ-1 и существенно влияют на прогрессирование болезни. Однако значимая роль этих клеток в первичной защите от инфекции пока не доказана.
По сравнению с ВИЧ-1-инфицированными, у которых количество лимфоцитов CD4 быстро снижается, у пациентов с длительным стабильным, непрогрессирующим течением болезни в изобилии обнаруживаются предшественники цитотоксических T-лимфоцитов, специфичные ко многим белкам ВИЧ-1. Связь более быстрого или медленного прогрессирования инфекции с определенными аллелями HLA может объясняться различной способностью этих аллелей к представлению вирусных антигенов, от которой зависит сила иммунного ответа (см. выше).
Описаны случаи, когда через несколько лет стабильного течения ВИЧ-инфекции с выраженным T-клеточным цитотоксическим ответом появлялись «ускользающие» от цитотоксических T-лимфоцитов мутантные штаммы ВИЧ-1 . Появление таких «ускользающих» мутантных штаммов совпадало с быстрым снижением числа лимфоцитов CD4, что свидетельствует о защитной роли цитотоксических T-лимфоцитов (Goulder 1997).
ВИЧ-1-специфичные цитотоксические T-лимфоциты были обнаружены у контактировавших с ВИЧ, но не заразившихся людей. У ВИЧ-отрицательных гетеросексуальных половых партнеров ВИЧ-инфицированных были обнаружены цитотоксические T-лимфоциты, специфичные к белку Nef, а у ВИЧ-отрицательных медицинских работников, уколовшихся ВИЧ-1- инфицированной иглой — специфичные к белку Env (Pinto, 1995). К сожалению, даже сильный цитотоксический ответ не защищает ВИЧ-1-инфицированных от суперинфекции другим, близким штаммом ВИЧ-1 (Altfeld, 2002).
Рост числа ВИЧ-специфичных цитотоксических T-лимфоцитов совпадает не только со спадом виремии в начальной стадии ВИЧ-1-инфекции, но также с перерывами в антиретровирусной терапии, особенно если она была начата на ранней стадии инфекции, как было обнаружено у лиц, которым проводилось структурированное прерывание терапии.
Однако до сих пор неясно, почему сильный T-клеточный цитотоксический ответ в большинстве случаев со временем ослабевает (Pantaleo, 2004). Возможно, при появлении «ускользающих» мутантных штаммов распознанные ранее эпитопы перестают быть иммунодоминантными.
Белок Nef может подавлять экспрессию антигенов HLA класса I и тем самым препятствовать распознаванию инфицированных клеток цитотоксическими T-лимфоцитами. Цитотоксические T-лимфоциты определяются в достаточном количестве у большинства ВИЧ-инфициро- ванных, однако непонятно, почему они не способны противостоять инфекции. Интересно, что цитотоксическим T-лимфоцитам ВИЧ-1-инфицированных присущи недостаток перфорина и незрелый фенотип по сравнению с эффекторными клетками, направленными против цитомегаловируса (Harari, 2002), хотя их способность секретировать хемокины и цитокины не нарушается (Appay, 2000). В другом недавно проведенном исследовании было доказано, что цитотоксическая активность ВИЧ-1-специфичных ЦТЛ связана с их способностью одновременно продуцировать интерферон-γ и ФНОα (Lichtenfeld, 2004). Поверхностные молекулы, например PD-1 (Programmed death 1 [рецептор программируемой смерти 1]) на ЦТЛ, которые появляются только на период клеточной активации, могут сохраняться при длительной антигенной стимуляции. Однако персистирующая экспрессия PD-1 может вызывать нарушение функции ЦТЛ; обратить этот эффект можно, заблокировав взаимодействие находящихся на поверхности ЦТЛ рецепторов PD-1 и находящихся на поверхности дендритных клеток лигандов PD-1L (Programmed death 1 ligand [лиганд рецептора программируемой смерти 1]) путем введения антител к PD-1. Это приводит к восстановлению функций ЦТЛ, таких как продукция цитокинов и цитотоксичность (Trautmann, 2006; Velu, 2009).
Лимфоциты CD8 также могут заражаться ВИЧ-1 (Bevan, 2004), хотя среди ВИЧ-1-специфичных T-лимфоцитов CD8 зараженных клеток обнаружено не было. Неясно, могут ли лимфоциты CD8 на какое-то время экспрессировать молекулы CD4 и какие корецепторы хемокинов участвуют в проникновении ВИЧ-1 в эти клетки.
59
1 3. Патогенез ВИЧ-1-инфекции
