
- •Предисловие
- •Теоретическое введение
- •1.1. Историческая справка
- •1.2. Возникновение скачка потенциала на границе
- •1.4. Гальванические элементы
- •1.5. Измерение эдс гальванических элементов
- •1.6. Электродные потенциалы. Стандартный водородный
- •1.7. Термодинамика гальванического элемента
- •1.8. Типы обратимых электродов
- •1.9. Классификация электрохимических (гальванических)
- •1.10. Диффузионный потенциал
- •1.11. Применение метода эдс (потенциометрического метода)
- •1.12. Химическая поляризация
- •1.13. Концентрационная поляризация
- •1.14. Перенапряжение водорода
- •1.15. Теория водородного перенапряжения
- •2. Тест для проверки знаний по теме «эдс»
- •Оглавление
1.15. Теория водородного перенапряжения
Перенапряжение обусловлено тем, что электролитическое выделение иона связано с преодолением некоторого энергетического барьера, для чего необходима затрата дополнительной энергии. Любой процесс, тормозящий выделение ионов на электроде, может быть причиной перенапряжения.
Рассмотрим подробнее теорию водородного перенапряжения. Процесс электролитического выделения водорода состоит из ряда последовательных стадий. Первой из них является транспорт ионов гидроксония к поверхности катода, осуществляемый диффузией. На второй стадии подошедшие к электроду гидратированные ионы водорода разряжаются по реакции
H3O+ + e → H + H2O2 ,
образовавшийся атомарный водород адсорбируется на поверхности. Затем наступает третья стадия процесса – рекомбинация двух адсорбированных атомов водорода в молекулу и удаление водорода в виде пузырьков из раствора. Суммарная скорость гетерогенного процесса определяется скоростью наиболее медленно его стадии. Поэтому необходимо выяснить, какая из перечисленных четырех стадий является наиболее медленной (лимитирующей).
Тафель предполагал, что такой стадией является процесс рекомбинации атомарного водорода. Позднее Эрдей-Грус и Фольмер показали , что лимитирующая стадия процесса – это разряд гидратированного иона водорода. Эта теория, называемая теорией замедленного разряда ионов, была далее развита в работах А.Н. Фрумкина, который существенно развил теорию замедленного разряда ионов, использовав современные представления о структуре двойного электрического слоя, образующегося на границе раздела фаз.
2. Тест для проверки знаний по теме «эдс»
Вариант 1
1. На положительном электроде гальванического элемента протекает реакция:
1) реакция восстановления,
2) реакция окисления,
3) окислительно – восстановительная реакция,
4) может быть и реакция окисления, и реакция восстановления.
2. Химическая реакция, протекающая в гальваническом элементе
Cd CdSO4 Hg2SO4(ТВ), Hg
имеет вид:
1) Cd −2е = Cd2+
2) Hg + CdSO4 = Cd + Hg2SO4(ТВ)
3) Cd + Hg2SO4(ТВ) = Hg + CdSO4
4) Hg + Cd2+ = Cd + Hg2+.
3. Давление газообразного хлора влияет на величину потенциала хлорного электрода так:
1) при увеличении давлении потенциал становится более положительным,
2) при увеличении давлении потенциал становится более отрицательным,
3) не влияет,
4) это зависит от условий эксперимента.
4. При работе в адиабатическом условиях гальванический элемент нагрелся. ЭДС этого элемента зависит от температуры так:
1) раст ёт,
2) не зависит,
3) падает,
4) на основании этих данных никакого вывода сделать нельзя.
5. Активность ионов кадмия, при которой направление тока в гальваническом элементе
Fe Fe2+ ( = 0.6) Cd2+ ( = х) Cd
меняется на обратное равно:
1) 0,0586 2) 0,01465
3) 0,0293 4) 0,0073.
Вариант 2
1. На отрицательном электроде гальванического элемента протекает реакция:
1) реакция восстановления,
2) реакция окисления,
3) окислительно – восстановительная реакция,
4) может быть и реакция окисления, и реакция восстановления.
2. Гальванический элемент, в котором протекает химическая реакция
Hg2Cl2 + H2 = 2Hg + 2 HCl,
имеет вид:
1) Hg, Hg2Cl2 KCl, HCl H2, Рt,
2) Hg, Hg2Cl2 KCl HCl H2, Рt,
3) Pt, H2 HCl Hg2Cl2 Hg,
4) Hg HCl H2, Рt, Hg .
3. Гальванические элементы, ЭДС которых не зависит от величин стандартных электродных потенциалов, имеют название:
1) это может наблюдаться для любых гальванических элементов при определённых условиях,
2) химические,
3) концентрационные,
4) такие гальванические элементы не существуют.
4. ЭДС гальванического элемента с помощью вольтметра измерить:
1) нельзя, так как при этом не будут соблюдаться условия электрохимического равновесия: через систему будет проходить ток и из-за электрохимической поляризации показания вольтметра не дадут истинного значения ЭДС,
2) можно, так как существуют вольтметры постоянного тока с очень большой степенью точности измерения,
3) нельзя, так как через систему пой дёт ток, а это вызывает диссоциацию электролита,
4) можно, если гальванический элемент правильно разомкнут.
5. ЭДС элемента Cd CdCl2 р-р AgCl, Ag при 250С равна 0,675В, температурный коэффициент ЭДС этого элемента равен - 6,5 . 10-4 В. Уравнение реакции, протекающей в этом элементе и значения ∆G, ∆S и ∆Н для этой реакции при 250С равны:
1) Ag+ + Cl- + Cd = AgCl + Cl-
-65.42 КДЖ; -63,0 ДЖ/К; -84,19 КДЖ,
2) 2 AgCl + Cd2+ = 2 Ag+ + 2 Cl- + Cd
-54,81 КДЖ; -520 ДЖ/К; -353,6 КДЖ,
3) AgCl + Cd = Ag + Cl- + Cd2+
65,4 КДЖ; 63,0 ДЖ/К; 168,4 КДЖ,
4) 2 AgCl + Cd = 2 Ag + CdCl2
-127.83 КДЖ; -126.0 ДЖ/К; -168.4 КДЖ.
Вариант 3
1. Условный электродный потенциал – это:
1) ЭДС элемента, составленного из данного электрода
и каломельного электрода,
2) ЭДС элемента, составленного из данного электрода
и стандартного водородного,
3) ЭДС элемента, в котором данный электрод соединён при измерении с элементом Вестона,
4) потенциал данного электрода в стандартных условиях.
2. Реакция, протекающая в гальваническом элементе
Ag, AgClТВ. KCl Cl2, Pt ,
имеет вид:
1) Ag + ½ Cl2 = AgClТВ.,
2) Ag + Cl- = AgClТВ.,
3) Ag+ + Cl- = AgClТВ.,
4) AgClТВ = Ag + ½ Cl2.
3. Учитывая, что средняя энергия катионов в металле ЕТВ. и средняя энергия катионов в растворе ЕР-Р, поверхность металла
заряжается положительно, если:
1) ЕТВ. > ЕР-Р,
2) ЕТВ. < ЕР-Р,
3) ЕТВ. = ЕР-Р,
4) поверхность металла в растворе, содержащем катионы этого металла. Всегда заряжена отрицательно.
4. Уравнение Нернста для окислительно- восстановительного электрода, на котором протекает реакция с участием ионов водорода rB – ne = pOK + nH+ ( ОК, В, Н+ - активности окисленной и восстановленной форм и иона водорода в растворе соответственно) имеет вид:
1)
 ,
,
2)
 ,
,
3) ,
,
4)
 .
.
5. ЭДС элемента Zn Zn2+ ( =1) Cu2+ ( = 1) Cu составляет 1,1В.
ЭДС элемента Zn Zn2+ ( =0,5) Cu2+ ( = 0,0005) Cu
равна:
1) 0,426 В 2) 0,763 В 3) 1.0115 В 4) 0,343 В.
Вариант 4
1. Химическими гальваническими элементами называют:
1) элементы, на электродах которых идут реакции окисления- восстановления,
2) элементы, электрическая работа которых получается за счёт химической реакции, идущей в элементе,
3) элементы, составленные из электрода любого типа и водородного электрода,
4) элементы, в ходе работы которых внутренняя энергия уменьшается.
2. Уравнение реакции, протекающей в гальваническом элементе Zn ZnCl2 AgCl, Ag имеет вид:
1) Zn + 2Ag+ = Zn2+ + 2Ag,
2) Zn2+ + 2Ag = Zn + 2Ag+,
3) Zn + 2AgCl = 2Ag + ZnCl2,
4) 2Ag + ZnCl2 = Zn + 2AgCl .
3. Учитывая, что средняя энергия катионов в металле ЕТВ. и средняя энергия катионов в растворе ЕР-Р, поверхность металла
заряжается отрицательно, если:
1) ЕТВ. > ЕР-Р,
2) ЕТВ. < ЕР-Р,
3) ЕТВ. = ЕР-Р,
4) поверхность металла в растворе, содержащем катионы этого металла всегда заряжена отрицательно
4. Знак ЭДС элемента считается положительным, если:
1) отрицательный заряд внутри элемента переносится слева направо,
2) положительный заряд внутри элемента переносится слева направо,
3) всегда,
4) потенциалы обоих электродов положительные.
5. ЭДС концентрационного элемента
Hg, Zn ( 1= 0.003) ZnSO4 P-P Zn, Hg ( 2 = 0.00001), где
1 и 2 - активности цинка в амальгаме, при 298 К равна:
1) 0,044 В 2) 0,550В 3) 0,008 В 4) 0,090 В.
Вариант 5
1. Электродные потенциалы водородного и хлорного электродов при увеличении давления изменяются (по абсолютной величине) так:
1) потенциал водородного электрода уменьшается, потенциал хлорного – увеличивается,
2) потенциал водородного электрода увеличивается, потенциал хлорного – уменьшается,
3) потенциалы и водородного и хлорного электродов увеличиваются,
4) потенциалы и водородного и хлорного электродов уменьшаются.
2. Выражение потенциала хлорсеребряного имеет вид:
1)
![]() ,
,
2)
![]() ,
,
3)
![]()
4)
![]()
3. Знаки электродов амальгамного концентрационного элемента, если α1 > α2 , имеют вид:
Hg, Cd CdSO4 Cd, Hg
α1 р-р α2
1) + − 2) − + 3) + + 4) − −.
4. Схематическая запись гальванического элемента, в котором протекает реакция 2Ag+ + CrO42- = Ag2CrO4, имеет вид:
1) Ag K2CrO4 KCrO2 Cr
2) Ag, Ag2CrO4 K2CrO4 AgNO3 Ag
3) Ag Ag2CrO4 AgNO3 Ag
4) Ag Ag2CrO4 K2CrO4 Cr.
5. Элемент, состоящий из водородного электрода (р=1атм), погружённого в раствор, и каломельного электрода, имеет ЭДС, равную 0,664В при 298К. Потенциал каломельного электрода равен 0, 242В. рН раствора и активность ионов водорода в нём равна:
1) 6,72; 1,91. 10-7 2) -1,93; 8,09. 1015
2) 7,15; 7,85. 10-4 3) 7,15; 7,10. 10-8.
Вариант 6
1. Стандартным водородным электродом называется:
1) потенциал водородного электрода при активности ионов водорода в растворе равной единице, и внешнем давлении равном единице,
2) потенциал водородного электрода при температуре 298К, погружённого в раствор с активностью ионов водорода, равной единице и внешнем давлении равном единице,
3) потенциал водородного электрода при температуре 298К, при концентрации ионов водорода в растворе равной 1 КГ- ион/м3 и внешнем давлении равном 1 НЬЮТОН/ М3,
4) потенциал водородного электрода, работающего в стандартных условиях, т. е. при активности ионов водорода в растворе, равной единице и при давлении, под которым водород насыщает платину, равен 1 атмосфере.
2. Уравнения для расчёта ∆ S, ∆G и ∆H при температуре Т1 для реакции, протекающей в гальваническом элемента, если его ЭДС как функция температуры выражается уравнением Е = а + bТ, имеют вид:
1) ∆ S = zFb; ∆ G = zF(а + bТ1); ∆H = zF(а + bТ1) + zFbT1,
2) ∆ S = zFb; ∆ G =-zF(а + bТ1); ∆H =-zF(а + bТ1)- zFbT1,
3) ∆ S = zFb; ∆ G =-zF(а + bТ1); ∆H =-zF(а + bТ1)+ zFbT1,
4) ∆ S = -zFb; ∆ G = zF(а + bТ1); ∆H = zF(а + bТ1)- zFbT1.
3. Химическая реакция, протекающая в гальваническом элементе Pt, H2 H+(p-p =1) Fe2+, Fe3+(p-p) Pt
PH![]() =1ATM
=1ATM
с указанием процесса, протекающего на правом электроде, имеет вид:
1) H+ + Fe2+ = ½ H2 + Fe3+, окисление,
2) ½ H2 + Fe3+ = H+ + Fe2+, восстановление,
3) ½ H2 + Fe3+ = H+ + Fe2+, окисление,
4) H+ + Fe2+ = ½ H2 + Fe3+, восстановление.
4. В газовом гальваническом элементе
Pt, H2 НCl (р-р =1,796) Сl2, Pt
PH =1ATM PH =2ATM
стандартный потенциал хлорного электрода равен 1,358В, а потенциал хлорного электрода и ЭДС соответственно равны:
1) - 1,440В и 1,505В
2) 1,328В и 1,724В
3) 1,440В и 1,505В
4) -1,150В и 1,433В.
Вариант 7
1. Уравнение Нернста для амальгамного
электрода (первого рода) имеет вид
(![]() -активность
металла в амальгаме,
-активность
металла в амальгаме,
![]() - активность ионов металла в растворе):
- активность ионов металла в растворе):
1)
![]() ,
,
2)
![]() ,
,
3)
![]() ,
,
4)
![]() .
.
2. Стандартный электродный потенциал никелевого электрода
равен -0,25В при 298К. Поверхность металлического никеля имеет заряд (положительный или отрицательный):
1) заряд поверхности будет равен нулю,
2) заряд поверхности может быть и положительным и
отрицательным. Это зависит соотношения энергии ио-
нов металла на поверхности и в растворе,
3) заряд будет отрицательный, так как стандартный потенциал этого электрода меньше нуля,
4) заряд будет положительным, так как он всегда противоположен по знаку стандартному потенциалу.
3. Условная запись гальванического элемента, в котором протекает следующая химическая реакция
Cu + 2 Fe 3+ → Cu2+ + 2 Fe3+
имеет вид:
1) Pt Fe3+ , Fe2+ Cu2+ Cu,
2) Cu Cu2+ Fe3+ , Fe2+ Pt,
3) Cu Fe2+ Cu2+ Fe,
4) Fe Cu2+ Fe2+ Cu.
4. У одного из следующих двух элементов, взятых при одинаковой температуре,
Cu CuSO4 ( = 0.1) CuSO4 ( =1.0) Cu E1
Zn ZnSO4 ( = 0.01) ZnSO4 ( = 0.01) Zn E2,
пренебрегая диффузионным потенциалом, ЭДС больше:
1) Е1 меньше Е2, 2) Е2 меньше Е1,
3) Е1 ≠ Е2, 4) Е1 равно Е2.
5. ЭДС элемента Рt, Н.2 Н+( = х) 0,1н КCl Hg2Cl2,Hg
равна 0,5 В при 298 К. Потенциал каломельного электрода равен 0,3358 В. Величина рН раствора, соприкасающего с водородным электродом равна:
1) 2,78 2) 4,7 3) 1,47 4) 2,0.
Вариант 8
1. Металл, погружённый в раствор, содержащий ионы этого металла, заряжается положительно, если соотношение энергиями ионов в металле и ионов растворе таково:
1) ЕМЕ больше ЕР-Р, 2) ЕМЕ равно ЕР-Р,
3) ЕМЕ меньше ЕР-Р, 4) ЕМЕ ≠ ЕР-Р,
2. На отрицательном электроде гальванического эемента происходит реакция:
1) реакция окисления,
2) реакция восстановления,
3) реакция окисления или восстановления, всё зависит второго электрода,
4) окислительно – восстановительная реакция.
3. Потенциал хлорсеребряного электрода будет больше в одном из следующих растворов KCl при 298 К: сантимоляльном, моляльном или насыщенном:
1) в насыщенном, 2) в децимоляльном,
3) в моляльном, 4) в сантимоляльном.
4. Схематическая запись гальванического элемента, в котором протекает реакция Ag+ + Cl- → AgClTB имеет вид:
1) Pt, Cl2 KCl AgClТВ, Ag,
2) Ag, AgClТВ KCl Cl2, Pt,
3) Ag AgNO3 KCl AgClТВ, Ag,
4) Ag, AgClТВ KCl AgNO3 Ag.
5. ЭДС амальгамного гальванического элемента при 298 К
Hg, Zn ( =0.05 ) ZnSO4 Zn, Hg ( =0.01)
равна:
1) 0,059 В 2) 0,0206 В
3) 0,0295 В 4) 0,0494 В
Вариант 9
1. Уравнение Нернста для хлорного электрода имеет вид:
1)
![]()
2)
![]()
3)
![]()
4)
![]()
2. Соотношение между энергиями иона в металле и в растворе, если металл, опущенный в раствор, заряжается отрицательно, таково:
1) металл будет заряжаться отрицательно всегда, независимо от соотношения между энергиями ионов в металле и в растворе,
2) энергия иона в металле меньше, чем энергия ио-
нов этого металла в растворе,
3) энергия ионов в металле равна энергии ионов это
го металла в растворе,
4) энергия ионов в металле больше, чем энергия ио-
нов этого металла в растворе.
3. При 298 К имеются стандартный водородный электрод и цинковый электрод, помещённый в раствор ZnSO4. Гальванический элемент из этих электродов и уравнение химическая реакции, протекающей в этом элементе, имеют вид:
1) Zn ZnSO4 H2SO4 H2, Pt Zn + H2 + 4e = Zn2+ + 2H+
2) Pt, H2 H2SO4 ZnSO4 Zn Zn2++ H2 = Zn + 2H+
3) Zn ZnSO4 H2SO4 H2, Pt Zn + 2H+ = Zn2+ + H2
4) Pt, H2 H2SO4 ZnSO4 Zn Zn2++ 2H+ = Zn + H2
4) Величина стандартной ЭДС гальванического элемента зависит:
1) от природы реакции, протекающей в данном элемен-
те, и температуры,
2) от природы реакции, протекающей в данном элемен-
те, концентрации растворов электролитов в полуэлемен
тах и температуры,
3) от температуры, числа переносимых электронов и,
концентрации растворов,
4) только от природы реакции, протекающей в данном
элементе.
5. Константа равновесия реакции Cu + 2Ag+ = Cu2+ +2Ag, рассчитанная по данным о стандартных электродных потециалах
(
![]() и
и
![]() )
равна:
)
равна:
1)3,02. 1015 2) 4,34. 1015
3) 7,31. 10-15 4) 4,34. 10-15.
Вариант 10
1. Для расчёта электрической работы гальванического элемента необходимы следующие данные:
1) ЭДС, температуру и число Фарадея,
2) ЭДС, число переносимых электронов и число Фарадея,
3) потенциалы отдельных электродов и число Фарадея,
4) число переносимых электронов и температуру.
2. Уравнение для кислородного электрода имеет вид:
1)
![]()
2)
![]()
3)
![]()
4)
![]()
3. Гальванический элемент, в котором протекает реакция
2Ag + Hg2Cl2 → 2AgCl + 2Hg
имеет вид:
1) Ag Ag+ Hg2+ Hg
2) Ag, AgCl KCl Hg2Cl2, Hg
3) Ag, AgCl Cl- Hg
4) Ag Ag+ KCl Hg2Cl2, Hg
4. Для гальванического элемента, работающего в обратимых условиях, ЭДС при 298 К больше, чем при 273 К. Решение вопроса о том, что элемент работает с выделением или поглощением тепла, имеет вид:
1) с поглощением,
2) может работать и с выделением и с поглощением
тепла, это зависит от знака теплового эффекта химической реакции, протекающей в элементе, 3) с поглощением,
4) для решения этого вопроса нужно знать величи- ну ЭДС при третьей температуре.
5. Изменение энтропии в ходе химической реакции
Pb + 2 Ag J = PbJ2 + 2Ag,
протекающей в гальваническом элементе при 298 К, если известно значение dE/ dT = - 1,33. 10-4 В/К, равно:
1) – 13,31Дж/К, 2) 26,63 Дж/К,
2) – 25,67 Дж/К, 4) 13,31 Дж/К.
Вариант 11
1.Стандартная ЭДС элемента - это:
1) ЭДС элемента, измеренная по отношению к элементу Вестона,
2) ЭДС элемента, составленного из любого электродаи стандартного водородного,
3) ЭДС элемента, работающего в стандартных условиях, т. е. при298 К и числе электронов, переносимых в ходе реакции, равном 1,
4) ЭДС элемента, составленного из двух стандартных электродов.
2. Из имеющихся веществ: Ag (металл), AgNO3, K2CrO4, AgNO2, Pt (металл), HNO3, K2Cr2O7, Ag2CrO4 электрод 2- го рода, электродная реакция и выражение потенциала этого электрода будут иметь вид:
1) Ag, Ag2CrO4 K2CrO4 2Ag – 2e + CrO42- → Ag2CrO4
![]() ,
,
2) Ag, Ag2CrO4 AgNO3 2Ag – 2e + CrO42- → Ag2CrO4
![]()
3) Pt AgNO3, AgNO2 NO3- - e → NO2- + ½ O2
 ,
,
4) Ag AgNO3 Ag – e → Ag+
![]()
3. Уравнение Нернста для потенциала хингидронного электрода имеет вид:
1)
![]() ,
,
2)
 ,
,
3)
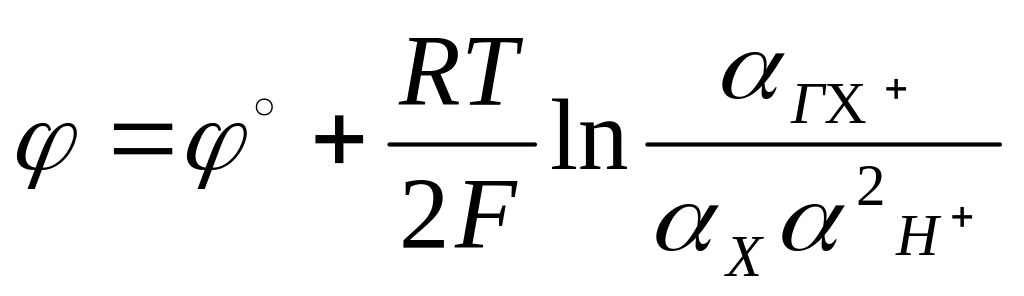
4)
![]()
4. Элемент Вестона относится к следующему типу гальванических элементов:
1) концентрационный, без переноса,
2) химический без переноса,
3) химический , с переносом,
4) концентрационный , с переносом.
5. Константа равновесия реакции
2 Fe3+ + 2J- = 2 Fe2+ + J2 ТВ.,,
протекающей в гальваническом элементе
при 298 К (![]() =
0,771В и
=
0,771В и
![]() 0,536
В), равна:
0,536
В), равна:
1) 9 .10-7 2) 104
3) 9 .107 4) 10-4.
Вариант 12
1. Уравнение Нернста для окислительно - восстановительного электрода ( - ионная активность окисленной формы, В – ионная активность восстановленной формы) имеет вид:
1)
 ,
,
2)
 ,
,
3)
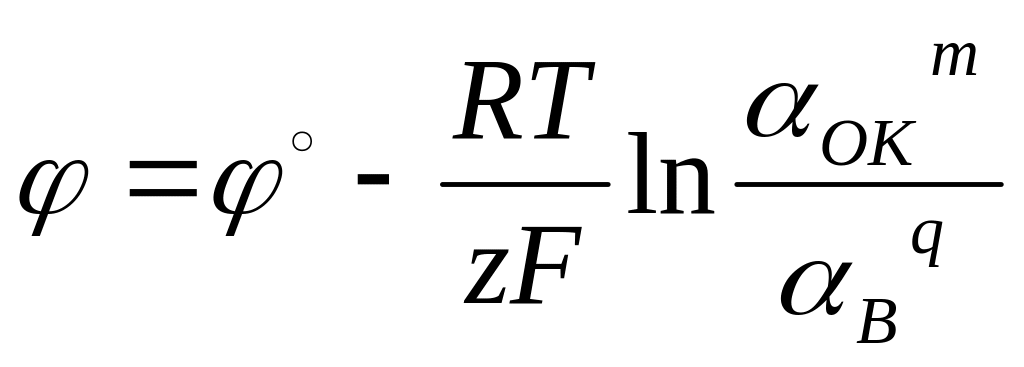 ,
,
4)
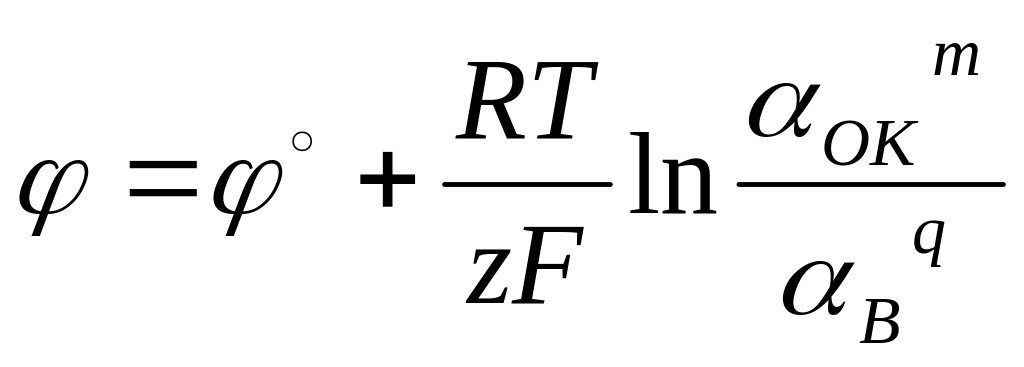 .
.
2. Из двух электродов: никеля, опущенного в раствор сернокислого никеля, и кадмия, опущенного в раствор сернокислого кадмия,- составлен гальванический элемент. Отрицательный полюс гальванического элемента при 298 К из этих электродов, если активность ионов никеля в растворе и активность ионов растворе равны и равны1, образует:
1) отрицательный полюс может образовывать как тот, так другой электрод,
2) никелевый,
3) кадмиевый,
4) оба будут отрицательными.
3. Условная запись гальванического
элемента из стандартного водородного
электрода и каломельного (![]() )
имеет вид:
)
имеет вид:
1) Pt, H2 H+ Cl- Hg2Cl2, Pt,
2) Pt, H2 H+ Cl- Hg, Pt,
3) Pt, H2 H+ Cl- Hg2Cl2, Hg,
4) Hg, Hg2Cl2 Cl- H2, Pt.
4. Гальванический элемент, в котором идёт следующая реакция 2FeCl3 + SnCl2 = 2FeCl2 + SnCl4 имеет вид:
1) Fe FeCl3 SnCl2 Sn,
2) Fe FeCl3 Sn2+, Sn4+ Pt,
3) Pt Sn2+, Sn4+ Fe2+, Fe3+ Pt,
4) Sn SnCl2 Fe2+, Fe3+ Pt.
5. Температурный коэффициент ЭДС гальванического элемента с одноэлектронным переходом равен нулю. Изменение энтальпии в ходе реакции, протекающей в этом элементе, если ЭДС равна1,1 В, равно:
1) -197,5 кДж, 2)-106,2 кДж,
3) 63,4 кДж, 4) 91,2 кДж.
Вариант 13
1. Каломельный электрод используется:
1) для определения рН раствора, которым заполняется этот электрод,
2) для определения коэффициента активности ионов в растворе, которым заполняется этот электрод,
3) для измерения ЭДС гальванических элементов,
4) как электрод сравнения для измерения потенциалов других электродов.
2. Условия, при которых стандартный электродный потенциал водородного электрода условно принимается за нуль:
1) под давлением газообразного водорода равном 1атм, активности ионов водорода в растворе равной1 и при температуре, равной 273 К,
2) под давлением газообразного водорода равном 1атм, активности ионов водорода в растворе равной1и при температуре, равной 298 К,
3) под давлением газообразного водорода равном 1атм, активности ионов водорода в растворе равной1и при лю бой температуре,
4) под давлением газообразного водорода равном
1атм, концентрации ионов водорода в растворе равной 1 г- ион/л и при любой температуре.
3. Величина стандартного электродного потенциала зависит:
1) от природы электродной реакции, температуры и природы потенциалопределяющих ионов,
2) от температуры, активности ионов в растворе и числа переносимых электронов,
3) от природы электродной реакции, температу- ры и присутствия посторонних ионов,
4) от природы электродной реакции и температуры,
4. Гальванический элемент работает с выделением тепла в окружающую среду. С ростом температуры его ЭДС изменяется так:
1) ЭДС возрастает,
2) ЭДС остаётся постоянной,
3)ЭДС падает,
4) для ответа надо знать, протекает в гальваническом элементе экзотермическая или эндотермическая реакция.
5. Химическая реакция Ag + Fe3+ → Ag + Fe2+ в водном растворе и при298 К. Возможность её протекания в заданных условиях и её константа равновесия равны:
1)Да. 1,52 2) Нет. 0,335
3) Да. 8,49 4) Нет. 0,906.
Вариант 14
1. Знак ЭДС элемента считается положительным, если:
1) отрицательный заряд внутри элемента переносится слева направо,
2) положительный заряд внутри элемента переносится слева направо,
3) всегда,
4) потенциалы обоих электродов положительные.
2. ЭДС гальванического элемента с помощью вольтметра измерить:
1) нельзя, так как при этом не будут соблюдаться условия электрохимического равновесия: через систему будет проходить ток и из-за электрохимической поляризации показания вольтметра не дадут истинного значения ЭДС,
2) можно, так как существуют вольтметры постоянного тока с очень большой степенью точности измерения,
3) нельзя, так как через систему пой дёт ток, а это вызы- вает диссоциацию электролита
4) можно, если гальванический элемент правильно разомкнут.
3. Уравнение для кислородного электрода имеет вид:
1)
2)
3)
4)
4. Стандартным водородным электродом называется:
1) потенциал водородного электрода при активности ионов водорода в растворе равной единице, и внешнем давлении равном единице,
2) потенциал водородного электрода при температуре 298К, погружённого в раствор с активностью ионов водорода, равной единице и внешнем давлении равном единице,
3) потенциал водородного электрода при температуре 298К, при концентрации ионов водорода в растворе равной 1 КГ- ион/м3 и внешнем давлении равном 1 НЬЮТОН/ М3,
4) потенциал водородного электрода, работающего в стандартных условиях, т. е. при активности ионов водорода в растворе, равной единице и при давлении, под которым водород насыщает платину, равен 1 атмосфере.
5. ЭДС элемента
Hg, Hg2Cl2 0.1н р-р KCl H+ р-р, рН-? хингидрон Pt
равна при 298 К 0,15В. рН раствора при
условии, что
![]() и
и
![]() равна:
равна:
1) 3,6 2) 4,16 3) 7,2 4) 8,3.
ЗАКЛЮЧЕНИЕ
Электродвижущие силы (гальванические элементы) – это раздел электрохимии, в котором изучается взаимосвязь химических и электрохимических явлений, а электрохимия в свою очередь является частью физической химии. Значит законы химической термодинамики применимы к химическим процессам, протекающим в гальванических элементах, что позволяет применять их к исследованию и измерению электродвижущих сил. Изучение этого раздела углубляет фундаментальную подготовку бакалавра, расширяет их кругозор, что необходимо выпускникам направлений, сталкивающимся в своей профессиональной деятельности с проблемами физико-химических явлений.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Стромберг, А. Г. Физическая химия [Текст]: учебник/ А. Г. Стромберг, Д. П. Семченко. – М.: Высшая школа, 2003.-527с.
2. Голиков, Г. А. Руководство по физической химии [Текст]: учеб. пособие./ Г. А. Голиков. – М.: Высшая школа, 1988.-383с.
3. Скорчеллетти, В. В. Теоретическая электрохимия [Текст]: учебник/ В. В. Скорчеллетти. – Л.: Химия, 1970.- 606с.
4. Краснов, К. С. Физическая химия [Текст]/ К.С. Краснов, И.Н. Годнев, Н.К. Воробьёв; под ред. К. С. Краснова. – М.: Высшая школа, 1982.- 687с.
