- •Вопросы по химии к модулю №3
- •Теория кислот и оснований Бренстеда (протолитическая теория). Равновесия в сопряженной кислотно-основной паре.
- •Теории кислот и оснований: теория электролитической диссоциации Аррениуса: понятия “электролитическая диссоциация”, “электролит”. “ион”, “катион”, “анион”.
- •Ступенчатый характер диссоциации слабых электролитов. Закон разбавления Оствальда (формулировка и математическое выражение).
- •Константа диссоциации слабых кислот и оснований (константа кислотности Ка, константа основности Кb) как константа равновесия процесса диссоциации. Показатель константы диссоциации (рКа и рКb).
- •Ионное произведение воды. Водородный показатель. РН и рОн растворов. Расчёт рН в растворах сильных и слабых электролитов.
- •Гидролиз солей. Биологическое значение.
- •Теория строения комплексных соединений (теория Вернера): внутренняя и внешняя сфера, комплексообразователь, лиганды, координационное число, дентантность.
- •Комплексообразующая способность s-р-и d- элементов. Её причины.
- •Классификация комплексных соединений по заряду внутренней сферы и характеру лиганда.
- •Номенклатура комплексных соединений.
- •Диссоциация комплексных соединений в растворе, константы нестойкости и стойкости комплексных соединений.
- •Биологическая роль комплексных соединений в организме.
- •Металло-лигандный гомеостаз и причины его нарушения.
- •Роль биогенных элементов в организме: классификации, топография химических элементов, содержащихся в организме человека. Биологическая роль макро- и микроэлементов.
Теории кислот и оснований: теория электролитической диссоциации Аррениуса: понятия “электролитическая диссоциация”, “электролит”. “ион”, “катион”, “анион”.
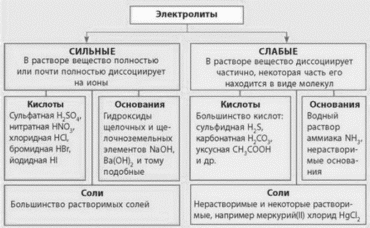
Для характеристики электролитов в водных растворах в настоящее время можно использовать понятия кислоты и основания, данные Аррениусом.
Согласно теории Аррениуса кислотой считается соединение, при электролитической диссоциации которого образуются катионы водорода, а основанием считается соединение, в результате диссоциации которого образуется гидроксид-ион.
Амфолитом (амфотерным гидроксидом) называют электролит, диссоциирующий в растворе с образованием как катионов водорода, так и гидроксид – ионов. К амфолитам относят гидроксиды цинка, алюминия, хрома и других аммфотерных элементов, а также аминокислоты, белки, нуклеиновые кислоты.
Таким образом, свойства кислот обусловлены наличием в их растворах водород - ионов, а свойства оснований - присутствием в их растворах гидроксид - ионов. Однако такой взгляд на кислоты и основания применим только для водных растворов. Ограниченность понятий кислоты и основания, данных Аррениусом, можно проиллюстрировать примерами:
1. Молекула NH3+ не содержит иона ОН-, а молекула СО2- иона H+,
однако в водном растворе первая проявляет свойства основания, а вторая - кислоты.
2. Безводный хлорид водорода, состоящий только из молекул, реагирует с безводными основаниями.
3. Многие электролиты, содержащие водород, в одном растворителе диссоциируют как кислоты, а в другом – как основания. Например,
СН3СООН в воде – слабая кислота:
СН3СООH СН3СОО-+ H+
а в жидком фториде водорода - основание:
НF+СН3СООH СН3СООH2++F
Исследования подобного типа реакций, и в особенности реакций, протекающих в неводных растворителях, привело к созданию более общих теорий кислот и оснований.
Электролитическая диссоциация — это процесс распада молекул на ионы при его растворении или плавлении.
Электролит — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов. Примерами электролитов могут служить кислоты, соли, основания и некоторые кристаллы.
Ион — атом или молекула, которая имеет электрический заряд. Если ион имеет положительный заряд, он называется катионом, а если отрицательный — анионом. В виде самостоятельных частиц ионы встречаются во всех агрегатных состояниях вещества: в газах, в жидкостях, в кристаллах и в плазме.
Степень диссоциации (α) электролита как количественная характеристика процесса диссоциации электролитов (деление электролитов на сильные и слабые по величине α). Факторы, влияющие на величину степени диссоциации.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации равна отношению продиссоциированных молекул вещества n к общему числу его молекул N. Выражается в долях или процентах.
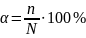
Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Например. Для уксусной кислоты CH3COOH величина {\displaystyle \alpha }\alpha равна 4% (в 0.01 М растворе). Это значит, что в водном растворе кислоты лишь 4 из каждых 100 молекул диссоциированы, то есть находятся в виде ионов Н+ и СН3СОО−, остальные же 96 молекул не диссоциированы. Как видно в таком примере, количества частиц, о которых идёт речь в определении степени диссоциации (они же концентрации при условии единичного объёма) - это равновесные количества (концентрации соответственно).