
- •Елена Александровна Ульрих Галия Феттяховна Кутушева Адилия Феттяховна Урманчеева Опухоли яичника: клиника, диагностика и лечение
- •Аннотация
- •Адилия Феттяховна Урманчеева, Галия Феттяховна Кутушева, Елена Александровна Ульрих Опухоли яичника (клиника, диагностика и лечение)
- •Введение
- •1. Эпидемиология
- •1.1. Заболеваемость, смертность и выживаемость
- •1.2. Этиология
- •1.3. Патогенез
- •2. Диагностика
- •2.1. Морфологическая и клиническая картина
- •2.1.1. Морфологическая классификация
- •2.1.2. Эпителиальные опухоли
- •2.1.3. Неэпителиальные опухоли
- •2.2. Методы диагностики
- •2.3. Скрининг
- •3. Лечение
- •3.1. Лечение доброкачественных опухолей
- •3.2. Лечение злокачественных опухолей
- •3.2.1. Лечение злокачественных эпителиальных опухолей (рака)
- •3.2.1.1. Стадирование
- •3.2.1.2. Лечение рака яичников ранних стадий
- •3.2.1.3. Лечение распространенного рака яичников (II–IV стадии)
- •3.2.1.4. Наблюдение после первичного лечения рака яичника (мониторинг)
- •3.2.1.5. Лечение рецидивов рака яичника
- •3.2.2. Лечение злокачественных неэпителиальных опухолей
- •3.2.2.1. Лечение герминогенных опухолей
- •3.2.2.2. Лечение стромальноклеточных опухолей (стромы полового тяжа)
- •4. Опухоли яичника в сочетании с беременностью
- •4.1. Диагностика
- •4.2. Лечебная тактика
- •4.2.1. Лечебная тактика при доброкачественных образованиях яичника
- •4.2.2. Лечебная тактика при злокачественных опухолях яичника
- •4.3. Фертильность после лечения злокачественных опухолей яичника
- •Заключение
- •Вопросы для самоконтроля
- •Список литературы
2.2. Методы диагностики
Как уже отмечалось ранее, большинство опухолей яичников имеют эпителиальное строение, доброкачественные и злокачественные варианты которых на начальных этапах заболевания не дают патогномоничных клинических симптомов. Боли возникают уже при довольно значительных размерах кист, и даже при наличии диссеминации метастазов злокачественных эпителиальных опухолей (рака) в брюшной полости клиника заболевания имеет стертый характер, выражающийся в «дискомфорте» со стороны желудочно‑кишечного тракта, увеличении объема живота за счет асцита. Почти 70 % больных раком яичников к моменту установления диагноза имеют III или IV стадии заболевания, тогда как у пациенток с неэпителиальными опухолями (стромальноклеточными, герминогенными) в 70 % случаев диагностируется I стадия заболевания. В отличие от эпителиальных опухолей яичников, герминогенные опухоли имеют солидное строение, поэтому болевые ощущения возникают на начальных этапах развития опухоли из‑за натяжения подвешивающей связки или ее перекрута. Опухоли, развивающиеся из стромы полового тяжа, являются гормонопродуцирующими, и симптомы заболевания могут быть проявлением гиперпродукции эстрогенов или андрогенов. Гранулезоклеточные опухоли яичников у девочек в пременархе стимулируют раннее половое созревание, у женщин репродуктивного возраста приводят к аменорее, а в постменопаузе вызывают постменопаузальные маточные кровотечения. Андрогенные опухоли яичников (опухоли Сертоли‑Лейдига) сопровождаются вирилизацией (см. раздел 2.1.2).
Клиническое ректовагинальное обследование малого таза нередко позволяет идентифицировать новообразование яичника. С 1970‑х годов благодаря внедрению ультразвуковых технологий наступила новая эра в диагностике опухолей яичников. Ультразвуковое исследование малого таза стало рутинным методом в обследовании женщины при подозрении на опухоль яичника. При небольших новообразованиях в малом тазу наибольшей информативностью обладает трансвлагалищная эхография, при образованиях более 6–7 см возрастает роль трансабдоминальной эхографии. При ультразвуковом сканировании здоровых женщин репродуктивного возраста яичник имеет гетерогенную структуру с развитым фолликулярным аппаратом, размером до 3–4 см в поперечном сечении. Увеличение размеров яичников у женщин в репродуктивном возрасте может быть вызвано опухолевидными образованиями, фолликулярными или лютеиновыми кистами. О функциональном характере данных образований свидетельствует их самопроизвольный регресс на протяжении нескольких менструальных циклов или при назначении оральных контрацептивов в течение двух‑трех месяцев. У женщин в постменопаузе яичники имеют однородную гипоэхогенную структуру, и их размеры не превышают 2 см. При ультразвуковом обследовании женщин этого возраста могут быть определены мелкие (от 1,5 до 3 см) гладкостенные кисты яичников. Для исключения злокачественности этих кист рекомендуется определение концентрации СА125 в крови, при нормальных показателях которого возможно динамическое наблюдение за пациентками пожилого и старческого возраста. В случаях повышения уровня СА125 показано безотлагательное хирургическое вмешательство. У женщин молодого возраста опухолевый маркер СА125 не является столь специфичным и его концентрация может меняться на протяжении менструального цикла и при неонкологических заболеваниях (см. далее опухолевые маркеры).
В дифференциальной диагностике доброкачественных и злокачественных опухолей предлагается учитывать ряд клиникоэхографических признаков. Цистаденомы (серозные, муцинозные), как правило, встречаются только с одной стороны, имеют небольшие размеры, однако муцинозные кисты могут быть гигантскими и занимать всю брюшную полость. Кисты имеют толстые гладкие стенки, гомогенную эхонегативную структуру (в муцинозных – с гиперэхогенной взвесью). Доброкачественные серозно‑папиллярные кисты характеризуются дополнительно единичными с четкими контурами гиперэхогенными зонами в области капсулы, что соответствует грубососочковым образованиям. Эндометриоидные кисты – чаще односторонние однокамерные образования с неравномерно утолщенной за счет пристеночных скоплений сгустков крови капсулой, содержимое кист неоднородной структуры с множеством эхопозитивных включений. В диагностике эндометриодных кист необходимо учитывать достаточно характерную клинику эндометриоза.
Доброкачественные герминогенные опухоли представлены зрелыми тератомами, чаще всего в виде дермоидных кист. Эхографическая картина последних представлена односторонними кистами с неоднородным внутренним содержимым, куда входят жировые элементы, кальцинаты, костная ткань. Типичный эхографический критерий – наличие т. н. «бугра», представляющего собой гиперэхогенное образование округлой формы. Остальные герминогенные опухоли (встречающиеся преимущественно у детей) имеют однородную гиперэхогенную структуру ввиду солидного строения образования. В случае выявления в них эхонегативных включений, указывающих на некрозы, можно думать о высокой злокачественности опухолевого процесса.
Рак яичника (злокачественные эпителиальные опухоли) на ранних стадиях заболевания, а именно IA и IB, эхографически представляет собой кистозное образование с единичными сосочковыми образованиями с нечеткими контурами, тогда как при 1C и II стадиях уже визуализируются обширные папиллярные разрастания с нарушением целостности капсулы кисты и в позадиматочном пространстве определяется небольшое количество жидкости (асцит). В дифференциальной диагностике доброкачественности и злокачественности опухолевого процесса ряд авторов рекомендует изучение кровотока в зоне опухоли с помощью цветной допплеросонографии. Определенные допплерографические структуры и снижение индексов резистентности (менее 0,6) и пульсации (менее 1,0) могут свидетельствовать в пользу злокачественности процесса. Однако этот раздел эхографической диагностики опухолей яичников требует дальнейших уточнений порогов его чувствительности и специфичности.
Для генерализованных стадий рака яичников (III и IV) эхографически характерно наличие неправильной формы опухолевого конгломерата кистозно‑солидного строения с размытыми границами и разрастаниями по наружному контуру. Асцит выявляется в 70–80 % наблюдений. Удается установить прорастание опухоли в матку, метастазы в клетчатке дугласова пространства в виде солидных гипоэхогенных узлов, поражение большого сальника, регионарных лимфатических узлов, брюшины. Эхографически метастазы в печени имеют вид одиночных или множественных гипо– или изоэхогенных очагов, окруженных анэхогенным ободком, размеры варьируют от 0,5 до 10 см и более, в центре больших узлов наблюдаются очаги некрозов. Использование цветного допплеровского картирования представляет дополнительные возможности для выявления метастазов в печени. Для этого изучают сосудистый рисунок печени, оценивают расположение сосудов и их количество на 1 см2. Описано два варианта ультразвуковой картины метастазов: гиперваскулярные и гиповаскулярные. Гораздо труднее диагностируются мелкие метастатические узлы (менее 0,5 см) в большом сальнике и по брюшине малого таза, в особенности при раздутых газом петлях кишки и ожирении. Выявление метастазов в забрюшинных лимфатических узлах затрудняется также из‑за спаечно‑инфильтративного процесса. В таблице 3 представлены эхографические параметры рака яичников в зависимости от степени распространения опухолевого процесса.
Таблица 3
Эхографические параметры рака яичников

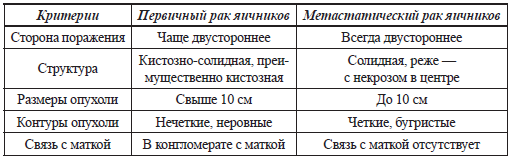
При выявлении эхографических признаков злокачественности опухолевого процесса в яичниках и за их пределами необходимо дифференцировать первичность и вторичность поражения яичников. Для вторичных (метастатических) опухолей яичников характерно двустороннее поражение солидными опухолями с четкими бугристыми контурами, небольших размеров, не спаянными с маткой, редко сопровождающимися асцитом. В таблице 4 представлены эхографические критерии дифференциальной диагностики первичного и метастатического рака яичников.
Достоинствами ультразвукового метода в диагностике опухолей яичников являются его высокая информативность (чувствительность, специфичность и точность достигают 80–90 %), простота, быстрота, безвредность, безболезненность, возможность объективного документирования и многократного проведения.
В качестве следующего этапа углубленной диагностики злокачественных опухолей яичников может быть названа рентгеновская компьютерная томография в случаях, когда эхография не дает четкого представления о степени опухолевого поражения. В основе метода лежит математическая обработка данных о поглощающей способности тканей в отношении рентгеновских лучей с получением поперечного изображения тканей, «пироговского среза». Благодаря серийным исследованиям с высокой вероятностью (чувствительность 80–85 %) возможно выявление метастазов в печени, большом сальнике, брыжейке кишки, забрюшинных лимфатических узлах. В настоящее время компьютерная томография является обязательным компонентом диагностики у пациенток со злокачественными опухолями яичников для получения полной информации о степени распространения опухолевого процесса.
Таблица 4
Эхографические критерии дифференциальной диагностики первичного и метастатического рака яичников
Магнитно‑резонансная томография является другим методом лучевой диагностики для оценки степени распространения злокачественного опухолевого процесса. В основе метода лежит избирательное поглощение различными тканями электромагнитного излучения. В отличие от компьютерной томографии, получение изображений возможно в различных проекциях, что важно для выявления прорастания опухоли в соседние органы – в прямую кишку, мочевой пузырь.
Позитронно‑эмиссионная томография (ПЭТ) – относительно новый диагностический метод ядерной медицины. В основе этого метода лежит возможность при помощи специального детектирующего оборудования (ПЭТ‑сканера) отслеживать распределение в организме биологически активных соединений, отмеченных позитрон‑излучающими радиоизотопами (радиофармпрепаратами). В настоящее время ведутся исследования по использованию ПЭТ с 18Р‑флюородеоксиглюкозой (FDG) для обследования пациентов с различными злокачественными опухолями, в том числе опухолями яичника для уточнения степени распространения заболевания.
Большое значение в диагностике злокачественных опухолей яичников отводится поиску опухолевых маркеров – специфических биологических веществ, продуцируемых опухолью, которые можно было бы определять биохимическими или иммунологическими методами. Наиболее известны в настоящее время две группы опухолевых маркеров: онкофетальные антигены (альфа‑фетопротеин и хорионический гонадотропин) и опухоль‑ассоциированные антигены (СА125, СА19‑9, СА72‑4, НЕ4).
Определение онкофеталъных антигенов (АФТ и ХГ) в крови у молодых пациенток с опухолевыми образованиями солидного строения в яичниках указывает на наличие герминогенной опухоли. Высокие уровни АФТ и ХГ говорят о плохом прогнозе заболевания, скорее всего, о наличии недисгермином. АФП наиболее часто повышен при опухоли желточного мешка, но может также определяться при незрелой тератоме и эмбриональном раке. ХГ часто повышен при хориокарциноме, эмбриональном раке и полиоэмбриоме. При дисгерминоме повышенный уровень ХГ могут обусловливать группы клеток сцинтиотрофобласта. Лактатдегидрогеназа (ЛДГ) неспецифична для герминогенных опухолей, но определение ее уровня может быть полезным при мониторинге в процессе лечения герминогенных опухолей яичников, негативных по ХГЧ и АФП, особенно в случаях дисгермином.
Определение уровня онкофетальных антигенов в процессе лечения и после его окончания позволяет судить об эффективности терапии.
В последние годы появились сообщения о значении ингибина В и антимюллерова гормона или ингибирующее вещество Мюллера (АМГ/ИВМ, AMH/MIS) как опухолевых маркеров для эстроген‑продуцирующих гранулезоклеточных опухолей.
Из опухоль‑ассоциированных антигенов наиболее изучен СА125. Данный опухолевый маркер представляет собой гликопротеиновый антиген, вырабатываемый клетками серозных злокачественных опухолей яичников и определяемый с помощью моноклональных антител. СА125 не является строго специфичным только для рака яичника, его уровень может быть повышен при циррозе печени, остром панкреатите, эндометриозе, миоме матки, беременности. У молодых женщин его концентрация в течение менструального цикла также может колебаться. Однако содержание СА125 выше 35 Е/мл определяется почти у 80 % больных раком яичников: у 90 % с распространенным раком яичников и у 50 % с ранними стадиями. Это значительно чаще, чем при неопухолевых патологических состояниях (в 5‑10 %) или у здоровых женщин (до 1 %). Поэтому СА125 является стандартом в обследовании женщины при обнаружении опухолевых масс в малом тазу, подозрительных по данным клинико‑эхографических исследований на рак. При этом возможность получения ложноположительных результатов среди здорового контингента обследуемых не позволяет использовать СА125 как опухолевый маркер для скрининговых программ с целью раннего выявления рака яичников. Наибольшее значение приобретает определение уровня СА125 в динамике проведения лечения рака яичника и в дальнейшем мониторинге за больными для выявления рецидивов заболевания.
В последние годы изучается комбинация СА125 с другими опухолевым маркером НЕ4. Сверхэкспрессия белка НЕ4 определяется в большинстве образцов серозного и эндометриоидного рака яичника, в половине случаев светлоклеточного и практически не обнаруживается в муцинозном раке яичника. НЕ4 секретируется в кровь, и его повышенные уровни обнаруживаются у 67 % больных раком яичника и в значительном числе случаев рака эндометрия, тогда как у здоровых лиц и пациенток с доброкачественными опухолями – лишь в 4 %. Также не было отмечено повышения уровней НЕ4 при эндометриозе и доброкачественных кистах яичников. R. М. Moore и соавт. (2007) обнаружили, что уровни НЕ4 повышены более чем в 50 % случаев рака яичника, не экспрессирующих СА125. Комбинация НЕ4 с СА125 давала наилучшую чувствительность (76 %) и специфичность (95 %) в дифференциальной диагностике злокачественного и доброкачественного процесса в яичниках и, по мнению исследователей, является более точным предиктором злокачественного процесса при наличии у женщины образований в малом тазу.
В конце обследования пациенток с подозрением на злокачественную опухоль яичников показано рентгенологическое исследование грудной полости для исключения метастатического плеврита. Рентгенологическое или эндоскопическое обследование желудочно‑кишечного тракта рекомендовано при наличии соответствующей симптоматики для исключения рака желудка с вторичным поражением яичников или же прорастания ректо‑сигмоидного отдела кишки опухолью яичника.
Все перечисленные методы диагностики могут с большей или меньшей долей вероятности указывать на доброкачественность или злокачественность опухолевого процесса. Окончательный диагноз может быть установлен только при морфологическом исследовании. При наличии асцита цитологическому исследованию могут быть подвергнуты мазки из осадка центрифугированной асцитической жидкости, полученной при лапароцентезе или пункции заднего свода влагалища. Обнаружение клеток аденокарциномы указывает на злокачественный процесс, но их отсутствие не исключает рак яичников.
При сохраняющихся сомнениях после проведения обследования перечисленными методами для постановки окончательного диагноза встает вопрос о хирургической процедуре лапароскопии или лапаротомии.
