
- •Схема активации фермента способом "ограниченного протеолиза"
- •Изменение активности фермента при фосфорилировании-дефосфорилировании
- •Зависимость активности ферментов обмена гликогена от наличия в структуре фосфорной кислоты
- •Общий принцип аллостерической регуляции
- •Регуляция фосфофруктокиназы конечным продуктом
- •Упрощенная схема активации аденилатциклазы
- •Активация протеинкиназы А при помощи цАМФ
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Кинетика конкурентного ингибирования
- •Кинетика неконкурентного ингибирования

ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. При данном ингибировании максимальная скорость реакции остается вполне достижимой
при создании высоких концентраций субстрата.
Например:
1)Ингибирование фермента цикла трикарбоновых кислот сукцинат-дегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).
Конкурентное ингибирование сукцинатдегидрогеназы
2)Также к конкурентным ингибиторам относят антиметаболиты или псевдосубстраты, например, антибактериальные средства сульфаниламиды, схожие по структуре с пара-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке возникает конкуренция между сульфаниламидом и пара-аминобензойной кислотой при синтезе дигидрофолиевой кислоты, что и вызывает лечебный эффект.
3)В качестве других примеров лекарственных конкурентных ингибиторов можно привести
ингибитор синтеза холестерина ловастатин, обратимо ингибирующий ГМГ-S-КоА-редуктазу,
противоопухолевый препарат метотрексат, необратимо подавляющий дигидрофолатредуктазу,
непрямой антикоагулянт дикумарол, конкурент витамина К,
антигипертензивный препарат метил-ДОФА, подавляющий активность ДОФА-декарбоксилазы,
средство для лечения подагры аллопуринол, ингибирующий ксантиноксидазу.
Кинетика конкурентного ингибирования
При таком виде ингибирования ингибитор конкурирует с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и снижению катализа. Используя терминологию кинетики Михаэлиса-Ментен можно сказать, что конкурентный ингибитор уменьшает сродство фермента к субстрату, повышая константу Михаэлиса (Km), максимальная скорость реакции (Vmax) остается при этом неизменнной.
Зависимость в координатах Лайнуивера-Берка имеет вид пучка прямых, пересекающихся на оси ординат. Конкурентный ингибитор увеличивает Кm и не изменяет Vmax.
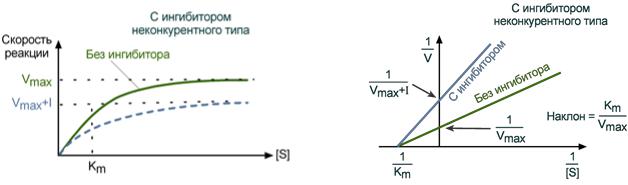
График конкурентного ингибирования в |
График конкурентного ингибирования в |
координатах Михаэлиса-Ментен |
координатах Лайнуивера-Берка |
Неконкурентное ингибирование
Данный вид ингибирования связан с присоединением ингибитора не в активном центре, а в другом месте молекулы. Но при этом меняется структура активного центра и связь с субстратом становится невозможной. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо веществ вне активного и аллостерического центра. Например:
синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание,
связывание ионов тяжелых металлов (Cu2+, Hg2+, Ag+) с SH-группами белков.
Особенностью неконкурентного ингибитора является его способность связываться с ферментом независимо от субстрата, т.е. изменение концентрации субстрата никак не влияет на образование комплекса фермент-ингибитор.
Кинетика неконкурентного ингибирования
Особенностью неконкурентного ингибитора является его способность связываться с ферментом не в активном центре, и изменение концентрации субстрата никак не влияет на это связывание. В то же время неконкурентный ингибитор не мешает связыванию субстрата с активным центром. В результате формируется тройной комплекс фермент-субстрат-ингибитор (E-S-I), в котором фермент уже не способен изменить свою конформацию и обеспечить проведение реакции. Количество "работоспособных" комплексов E-S при этом снижается.
Максимальная скорость реакции (Vmax) при неконкурентном ингибировании снижается, константа Михаэлиса (Km) не изменяется, т.е. добавление дополнительного субстрата не может повлиять на состояние активного центра и работу фермента.
Зависимость в координатах Лайнуивера-Берка имеет вид пучка прямых, пересекающихся на оси абсцисс. Неконкурентный ингибитор не изменяет Кm и снижает Vmax.
График неконкурентного ингибирования |
График неконкурентного ингибирования |
в координатах Михаэлиса-Ментен |
в координатах Лайнуивера-Берка |
