
- •Виды ингибирования
- •1. Обратимое 2. Необратимое
- •Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9
- •1. Специфические и неспецифические ингибиторы
- •1. Пространственная локализация ферментов
- •2. Структура метаболических путей
- •1. Регуляция количества молекул фермента в клетке
- •2. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов
- •3. Регуляция каталитической активности ферментов
- •Основные способы регуляции активности ферментов:
- •Аллостерическая регуляция
- •Регуляция каталитической активности ферментов белок-белковыми взаимодействиями.
- •Активация ферментов в результате присоединения регуляторных белков.
- •Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров.
- •Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования
- •Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
- •Нарушение образования конечных продуктов
- •Энзимодиагностика
- •Энзимотерапия -
Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования
В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространённый способ химической модификации ферментов - фосфорилирование/дефосфорилирование (ОН-группы фермента): фосфорилирование осуществляется ферментами протеинкиназами, дефосфорилирование - фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. Результат: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными.
Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами фосфопротеинфосфатазами. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды. Антагонистичные по функции гормоны противоположным образом влияют на фосфо-рилирование/дефосфорилирование ферментов, вызывая противоположные эффекты изменения метаболизма клетки.
Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза энергетического материала - жира, гликогена и усиление его распада (мобилизация), вызванного фосфорилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов.
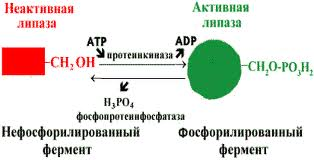

Регуляция активности ферментов фосфорилированием/дефосфорилированием.
Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента.
Трипсиноген, синтезируемый в поджелудочной железе, при пищеварении по протокам поджелудочной железы поступает в двенадцатиперстную кишку, где и активируется путём частичного протеолиза под действием фермента кишечника энтеропептидазы. В результате отщепления гексапептида с N-конца формируется активный центр в оставшейся части молекулы. Трипсин относят к семейству "сериновых" протеаз - активный центр фермента содержит функционально важный остаток Сер.
Частичный протеолиз - пример регуляции, когда активность фермента изменяется необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации протеолитических ферментов, белков свёртывающей системы крови и фибринолиза, белков системы комплемента, а также пептидных гормонов.

Интенсивность протекания биохимических процессов определяется функционированием ферментных систем клетки.
Регуляция деятельности ферментного аппарата клетки осуществляется изменением каталитической активности ферментов - быстрый механизм регуляции, или
изменением концентрации ферментов - медленный механизм регуляции.
Различают следующие уровни регуляции биохимических процессов через ферментные системы клетки:
1.Низший - изменение каталитической активности ферментов вследствие изменения факторов среды: концентрация субстрата, концентрация кофакторов, концентрация продуктов реакции, рН среды, температура, присутствие ингибиторов или активаторов.
2.Изменение каталитической активности регуляторных ферментов.
3.Изменение интенсивности синтеза ферментов под влиянием метаболитов (в основном у прокариот).
4.Высший - изменение функционирования ферментного аппарата клетки под влиянием гормонов, которые или сами проникают в клетку, в ядро (стероидные и тиреоидные гормоны), или действуют на наружные рецепторы клетки (белково-пептидные гормоны и катехоламины).
МЕДИЦИНСКИЕ АСПЕКТЫ ЭНЗИМОЛОГИИ
Медицинской биохимии принадлежит существенная роль в процессе познания патогенетических механизмов. Еще два века назад М.В. Ломоносов писал, что «медик без довольного знания химии совершенно быть не может».
Основная задача медицинской биохимии заключается в выяснении компенсаторных механизмов нарушенных этапов метаболических процессов в клетке и способов управления этой компенсацией. Успешно развивается новое направление энзимологии - медицинская энзимология по трем главным направлениям: энзимопатологии, энзимодиагностики и энзимо-терапии.
ЭНЗИМОПАТИИ
Нарушения функционирования ферментов в клетке – энзимопатии:
- первичные (наследственные),
- вторичные (приобретённые).
Первичные энзимопатии: дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей. При этом развитие заболевания может протекать по одному из ниже перечисленных "сценариев". Условную схему метаболического пути:
![]()
