
6 курс / Неонатология / Неонатология_Н_П_Шабалов_7_е_издание_Том_2_2020
.pdfдефицита MtHb-R гораздо более высокая, в частности среди якутов - 7% (Токарев Ю.Н.,
1985).
У гомозигот с рождения выявляется цианоз кожи и видимых слизистых оболочек, особенно заметный в области губ, носа, мочек ушей, ногтевого ложа,
полости рта. Спектр окрашивания варьирует от серо-землистого до темно-фиолетового. Заболевание носит доброкачественный характер. При уровне MtHb, превышающем 30% и более, дети становятся возбужденными, усиливаются типичные для них тахикардия, тахипноэ, цианоз, могут появиться приступы апноэ. Количество эритроцитов и уровень гемоглобина в единице объема крови повышены, но из-за того, что MtHb не способен к оксигенации, ткани испытывают гипоксию, т. е. имеется «скрытая анемия». Развитие детей при отсутствии наслоения другой патологии существенно не страдает. М-гемоглобинемия. При мутации в α-цепи глобина дети цианотичны с рождения, при мутации в β-цепи цианоз появляется с 3-6 мес жизни, когда происходит замена основной части HbF на HbA.
Клиническая картина та же, что и при НФМ.
Диагноз основан на том, что у детей с очень смуглой коричневой кожей, цианозом не находят причин для этого - отсутствуют болезни сердца (врожденные пороки синего типа), легких, надпочечников. Мысль о присутствии MtHb в крови легко подтвердить - осторожно в течение 30 с помахать фильтровальной бумажкой, на которую нанесена капля крови больного и рядом - капля обычной крови. Обычная венозная кровь становится красной из-за наличия в ней HbO2, тогда как при метгемоглобинемии кровь продолжает оставаться коричневого цвета. Если эта проба оказалась положительной, необходимо углубить обследование: определить уровень MtHb циангемоглобиновым методом, активность НАДН-зависимой MtHb-R, электрофорез гемоглобинов и т. д.
Приобретенные метгемоглобинемии развиваются у гетерозигот НФМ, лиц с гемоглобинопатиями, при использовании долго хранившихся лекарственных средств, в том числе фенацетина, сульфаниламидов, анилина и его дериватов, а также воды и продуктов с большим количеством нитритов и нитратов (колодезная вода, а иногда и водопроводная вода, колбаса, баночные мясные консервы, овощи и фрукты, выращенные с использованием нитритных и нитратных удобрений), некоторых «народных» настоев трав и кореньев, имеющих «сладкий дух нитратов».
Лечение. У взрослых обычно начинают лечение, если уровень MtHb более 40%. Новорожденным и грудным детям назначают аскорбиновую кислоту (0,1-0,15 внутрь 3 раза в день) и/или рибофлавин по 0,01 внутрь 2-3 раза в день. Возможно введение метиленового синего (хромосмон) в дозе 1-2 мг/кг внутривенно. Уровень MtHb уже через час нормализуется, но, к сожалению, через 2-3 ч он вновь повышается, поэтому препарат дают внутрь в той же дозе 3 раза в день. Если повторные введения метиленового синего неэффективны, то детей обследуют на М-гемоглобинемии или дефицит глюкозо-6- фосфатде-гидрогеназы эритроцитов.
18.2. НЕЙТРОПЕНИИ
Нейтропенией принято считать снижение количества нейтрофилов в периферической крови доношенных новорожденных в течение первых 3 нед жизни
менее 1500 в 1 мкл, но клинически значимой нейтропенией, при которой снижается чувствительность к бактериальным инфекциям, считают их число менее 1000 в мкл, и особенно велик при числе менее 500 в мкл (Maheshwari A., 2013). Однако в раннем неонатальном периоде в связи с физиологической активацией гранулоцитопоэза - физиологическая нейтрофилия (сочетается со значительно повышенными при рождении и в первые часы жизни уровнями в крови гранулоцитарного и гранулоцитарно-

макрофагального колониестиму-лирующих факторов) эта величина иная (см. табл. 14.10,
рис. 18.4).
Рис. 18.4. Определение нейтропении (Maheshwari A., 2013). Рисунок а представляет область изменений количества нейтрофилов у новорожденных (между пунктирными линиями), под сплошной линией - нейтропения для детей с массой тела больше 1500 г (Manroe D.L. et al., 1979). Рисунок б представляет область изменений количества нейтрофилов у новорожденных (между пунктирными линиями), под сплошной линией - нейтропения для детей с массой тела менее 1500 г (Mouzinho A. et al., 1994)
Согласно A. Maheshwari (2013), в США нейтропению регистрируют у 8% детей отделений интенсивной терапии новорожденных (у недоношенных
6-58%).
Причины возникновения нейтропении у новорожденных (Maheshwari A., 2013)
Снижение продукции нейтрофилов
Дети женщин с артериальной
гипepтeнзиeй (точная этиология неизвестна; возможные причины включают присутствие плацентарного ингибитора продукции нейтрофилов, сниженную чувствительность клеток-предшественников к гpaнyлoцитapнoмy кoлoниecтимyлиpyющeмy
Повышенная деструкция нейтрофилов Сепсис, вызванный бактериями или грибами (усиленная миграция нейтрофилов в ткани; низкая продукция в костном мозге).
Некротический энтероколит (истощение пула
циркулирующих нейтрофилов вследствие усиленной миграции в
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
фактору). Доноры фeтo-фeтaльныx |
кишечник и брюшину, повышенное |
|
трансфузий. |
краевое стояние). Неонатальная |
|
Новорожденные с Rh-гeмoлитичecкoй |
aллoиммyннaя |
|
нeйтpoпeния (аналогична Rh- |
||
болезнью («кража» клеток- |
||
гемолитической болезни |
||
предшественников, когда развитие клеток- |
||
новорожденных, когда у матери |
||
предшественников переходит на путь |
||
образуются антитела к антигену, |
||
эpитpoиднoй диффepeнциpoвки). |
||
унаследованному плодом от отца и |
||
|
||
Врожденные нeйтpoпeнии/cиндpoмы |
присутствующему на фeтaльныx |
|
недостаточности костного мозга |
нeйтpoфилax). Неонатальная |
|
Синдром Kocmмaнa (остановка созревания и |
аутоиммунная нeйтpoпeния (антитела к |
|
нeйтpoфилaм, пассивно |
||
повышенный aпoптoз клеток- |
||
приобретенные от матери, страдающей |
||
предшественников; мутации элacтaзы |
||
аутоиммунной |
||
нейтрофилов, приводящие к исключительно |
||
нeйтpoпeниeй). Аутоиммунная |
||
мембранной локализации фермента). |
||
нeйтpoпeния детей (ребенок становится |
||
|
||
Ретикулярная дucгeнeзuя (наследственный |
сенсибилизированным к ayтoaнтигeнaм, |
|
иммунодефицит с поражением миeлoид-нoгo |
присутствующим на нeйтpoфилax, и |
|
и лимфoиднoгo ростков кроветворения). |
продуцирует антитела против |
|
Синдром Барта (органическая |
собственных нейтрофилов). Другие |
|
причины |
||
aминoaцидypия, дилaтaциoннaя |
||
|
||
кapдиoмиoпaтия и нeйтpoпeния; |
Идиoпaтичecкaя нeйтpoпeния |
|
предположительно нeйтpoпeния обусловлена |
новорожденных (диагноз |
|
дефектом мембраны нейтрофилов). |
устанавливается методом исключения; |
|
Синдром Швaxмaнa- |
легко обратима при лечении |
|
гранулоцитарный |
||
Дaйeмoндa (недостаточность экзoкpиннoй |
||
кoлoниecтимyлиpyющим фактором). |
||
функции поджелудочной железы и |
||
|
||
нейтропении; дефект протеина SBDS, |
Лекарственно индуцированная |
|
который может участвовать в pибocoмaльнoм |
нeйтpoпeния (может быть вызвана |
|
биогенезе). |
многими лекарствами; в OИTH |
|
Гипоплазия хрящевой ткани и волосистого |
причиной ее возникновения обычно |
|
считают антибиотики группы ß- |
||
покрова (карликовость с короткими |
||
лaктaмoв, тиaзидныe диуретики, |
||
конечностями; нарушение пролиферации |
||
paнитидин, aциклoвиp). |
||
клеток-предшественников |
||
|
||
нейтрофилов). Циклическая |
Πceвдoнeйтpoпeния (доброкачественное |
|
нeйmponeнuя (циклический |
состояние, когда пул циркулирующих |
|
гeмoпoэз С максимальным снижением уровня |
нейтрофилов меньше, чем пул, |
|
нейтрофилов с 3-нeдeльными интервалами; |
участвующий в краевом стоянии у |
|
мутации элacтaзы нейтрофилов, |
сосудистой стенки). Apтeфaктнaя |
|
предотвращающие мембранную локализацию |
нeйтpoпeния (доброкачественное |
|
фермента). Наследственные дефекты |
состояние, когда нeйтpoфилы |
|
метаболизма |
агглютинируют при воздействии ЭДTA, |
|
Органические aцuдeмuu (промежуточные |
которую используют в качестве |
|
антикоагулянта в образцах крови in |
||
продукты обмена ингибиpyют пролиферацию |
||
vitro) |
||
клеток-предшественников). |
||
|
||
Γлuкoгeннaя болезнь типа 1b (повышенный |
|
|
aпoптoз нейтрофилов). |
|
|
|
|
Вирусные инфекции (инфекция клеток-
предшественников, гипepcплeнизм).
Краснуха.
Цитoмeгaлoвиpyc.
Дефицит меди.
Aллoиммyннaя
нeйтpoпeния, ассоциированная с антителами aнти-NBl (NBl-aнтигeн присутствует на клетках-предшественниках нейтрофилов)
Применение колониестимулирующих факторов вполне целесообразно при тяжелых гранулоцитопениях и наслоении инфекций. Используют либо рекомби-нантный гранулоцитарный колониестимулирующий фактор (рГ-КСФ) (фил-грастим, Граноцит♠, Нейпоген♠) внутривенно или подкожно в дозе 5-10 мкг/кг 5-10 дней подряд, либо гранулоцитарно-макрофагальный колониестимулирующий фактор (молграмостим, Лейкомакс♠) в той же дозе 7-10 дней. Эффект ко-лониестимулирующих факторов выявляется уже через 24 ч: в периферической крови увеличивается количество нейтрофилов. При аллоиммунной нейтропе-нии, по мнению M. Gilmore и соавт. (1994), после введения колониестимулирующих факторов в крови появляются нейтрофилы с меньшей экспрессией NA I и NА II. По данным обзоров R.W. Sweetman и соавт. (1998), L. Luchtman-Jonts и соавт. (2002), это эффективный и безопасный (при изучении двухлетнего ка-тамнеза) метод лечения как при аллоиммунной и других неинфекционных неонатальных нейтропениях, так и при неонатальном сепсисе, хотя увеличения выживаемости больных с неонатальным сепсисом при умеренных нейтропениях не получено (Maheshwari A., 2013).
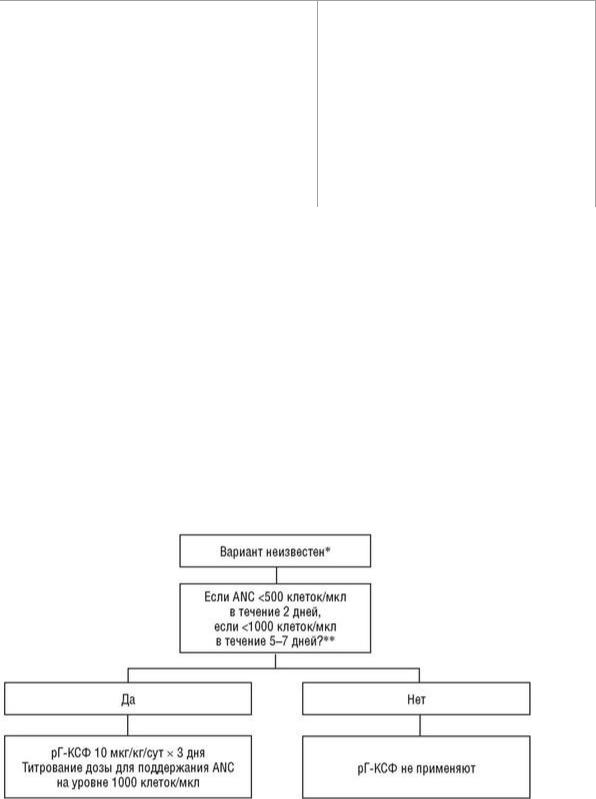
Рациональный подход к применению рГ-КСФ у новорожденных представлен на схеме
(рис. 18.5).
Рис. 18.5. Рекомендации, помогающие решить, как лечить нейтропению в ОИТН с помощью рГ-КСФ, в зависимости от варианта нейтропении (Calhoun D.А. et al., 2000): ANC - абсолютное число нейтрофилов; рГ-КСФ - рекомбинантный гранулоцитарный колониестимулирующий фактор. * Вариант нейтропении может быть известен (или подозревается с высокой степенью вероятности) на основании данных семейного анамнеза (синдром Костмана или циклическая нейтропения), обстоятельств беременности (гипертензия, индуцированная беременностью; малая масса для гестационного возраста) или обстоятельств, связанных с особенностями новорожденного (синдром фето-фетальной
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
трансфузии, Rh-гемолитическая болезнь, некротизирующий энтероколит). ** Международный регистр тяжелой хронической нейтропении -
http://depts/washington.edu/registry/
К изложенному лишь стоит добавить, что при аллоиммунных и аутоиммунных нейтропениях с успехом было использовано внутривенное
введение иммуноглобулинов с частотой положительного эффекта примерно
50% (Maheshwari A., 2013).
18.3. ОСОБЕННОСТИ ГЕМОСТАЗА У НОВОРОЖДЕННЫХ
Система гемостаза обеспечивает, с одной стороны, предупреждение и остановку кровотечений, а с другой - сохранение жидкого состояния циркулирующей крови, поэтому проявлением расстройств системы гемостаза могут быть как тромбозы, так и повышенная кровоточивость, геморрагии. Существует афоризм: «Нитью фибрина начинается (тромбирование пупочных сосудов) и кончается жизнь человека».
Особенности системы гемостаза при рождении у здоровых доношенных детей следующие.
1. Тенденция к гиперкоагуляции цельной крови при рождении (укорочены протромбиновое и тромбиновое время, повышенное количество в крови 1,2-фрагментов протромбина, пептида, активирующего протеин С, энзимов, ингибирующих комплекс «антитромбин III - тромбин», продуктов деградации фибриногена и фибрина) на фоне:
•низкого уровня (50-60% уровня в плазме у взрослых и детей старше 1 мес жизни) как прокоагулянтов (II, VII, IX, X факторы), факторов контакта (XI, XII, прекалликреин и высокомолекулярный кининоген), так и многих антикоагулянтов (антитромбин III, протеины C и S);
•нормального уровня факторов I (фибриноген при рождении - фе-тальный, содержит повышенное количество сиаловых кислот и фосфора, количество N-терминального аланина в α-цепи; он обладает меньшей активностью, хотя полностью значение его не расшифровано)
и V, XIII;
• повышенного уровня факторов VIII, фактора Виллебранда (фВ) и его крупных мультимеров, концентрация которых в плазме при рождении намного выше, чем у взрослых; фВ синтезируется эндотелиальными клетками в виде крупных мультимеров, которые в плазме расщепляются метал-лопротеиназой ADAMTS, активность которой у новорожденных снижена (нормализуется к 3 мес жизни); повышенный уровень мультимеров фВ как бы компенсирует низкую функциональную активность тромбоцитов после рождения.
2.Транзиторно (в пределах первого получаса часа жизни) резко повышенная активность фибринолиза (за счет высокого уровня активаторов плазминоге-на при низком уровне их ингибиторов и тканевых активаторов плазминогена), большое количество в крови гепарина, продуктов деградации фибриногена и фибрина (ПДФ) при сравнительно низком уровне плазминогена (50-60% уровня у детей старше 1 мес и взрослых).
3.Нормальное количество тромбоцитов при рождении (при изучении при помощи электронного микроскопа тромбоциты новорожденных не отличаются от тромбоцитов взрослых и имеют все виды гранул) с некоторым снижением количества к концу 1-го дня жизни.
4.Активация тромбоцитов в пуповинной крови (судя по повышенному уровню в крови тромбоксана В, β-тромбоглобулина, тромбоцитарного фактора роста), что подтверждено и при изучении на анализаторе функции тромбоцитов (модель PFА-100), но низкая к концу 1-х суток жизни их способность к адгезии (хотя уровень гликопротеина, определяющего эту способность, GP Ib - у них в норме, а фВ даже повышен по сравнению со взрослыми) и агрегации с коллагеном, АДФ, адреналином (хотя рецепторы, определяющие эту способность: GP IIb и IIIa - представлены) при укороченной или нормальной длительности кровотечения.
5.Повышенная проницаемость, хрупкость сосудистой стенки при высокой ее простациклиновой активности и способности синтезировать оксид азота (простациклин и NO ингибируют агрегацию тромбоцитов и способствуют ва-зодилатации).
В дальнейшем (рис. 18.6):
•На 2-3-й день жизни из-за сравнительно низкой белково-синтетической функции печени и у большинства детей дефицита витамина К уровни в плазме крови факторов протромбинового комплекса (витамин К-зави-симые прокоагулянты крови - II, VII, IX, X факторы) снижаются до 3040% уровня взрослых и далее повышаются, но даже к 6 мес уровень большинства из них ниже, чем у взрослых (см. табл. 18.12), что, возможно, связано с бóльшим их клиренсом (меньшей продолжительностью жизни в крови ребенка). Согласно данным M. Andrew и соавт. (1998) способность к генерации тромбина плазмы новорожденных составляет 50% уровня взрослого, но и к 6 мес она снижена по сравнению со взрослыми на 20%. Хотя уровень антитромбина III у новорожденных и снижен, но за счет других антикоагулянтов общая антитромбиновая активность плазмы у них не отличается от таковой у взрослых (Andrew M. et al., 1998).
•Уже во второй половине 1-го получаса жизни активность фибринолиза резко снижается, и на протяжении первых 2 сут отмечается дефицит фибрино-лиза (особенно выраженный у недоношенных). Плазминоген сразу после рождения - фетальный и характеризуется сниженным количеством ман-нозы и повышенным - сиаловых кислот, имеет пониженную энзиматиче-скую активность и меньше связывается с рецепторами плазминогена (Andrew
M. et al., 1998).
•Увеличивается адгезивно-агрегационная способность тромбоцитов. Она устанавливается (т. е. становится такой же, как у взрослых) по отношению к различным агрегантам в разное время, но считается, что это происходит на второй неделе жизни.
•У здоровых доношенных детей, развивавшихся внутриутробно при не-осложненном течении беременности у соматически здоровых матерей, описанные особенности гемостаза не сопровождаются какими-либо проявлениями склонности к кровоточивости и в дальнейшем в течение нескольких недель постепенно нивелируются.
Суммарно особенности плазменного звена неонатального гемостаза приведены в табл.
18.9.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Рис. 18.6. Динамика основных плазменных факторов свертывания крови в период новорожденности (Тур А.Ф., Шабалов Н.П., 1970): 1 - тромбопластическая активность крови (%); 2 - протромбиновый индекс (%); 3 - факторы V и Виллебранда (%); 4 - фактор
VII (%); 5 - факторы VIII и XII (%); 6 - фактор IX (%); 7 - фактор X (%); 8 - антитромбин
III (%); 9 - время рекальцификации (с); 10 - фибринолитическая активность (%); 11 - фибриноген (мг%)
Таблица 18.9. Неонатальный гемостатический баланс (Manco-Johnson M.J., 2013)
Повышенная |
Недостаточная |
Фетальные |
Фетальные |
концентрация в плазме и |
концентрация в плазме |
молекулярные |
молекулярные |
раннее развитие |
и замедленное развитие |
формы |
формы с утратой |
факторов |
факторов |
с приобретением |
функции |
|
|
свертывания |
|
|
|
функции |
|
|
|
|
|
|
|
свертывания |
|
Прокоагулянтные |
Витамин-К-зависимые |
Фактор |
Фибриноген. |
факторы: VIII, V, XIII, |
факторы: II, VII, IX, X, |
Виллебранда |
Плазминоген/ |
фибриноген, тканевой |
|
||
|
|
плазмин |
|
фактор. Фактор |
протеин С, протеин S. |
|
|
|
|
||
Виллебран-да, уровень |
Антитромбин, |
|
|
тромбоцитов. |
|
|
|
ингибитор тканевого |
|
|
|
|
|
|
|
Тканевой фактор. |
активатора (TFPI). |
|
|
Тромбомодулин |
Активируемый |
|
|
|
|
|
|
|
тромбином |
|
|

фибринолитический фактор (TAFI)
Приведенные сведения слишком схематично представляют состояние системы гемостаза новорожденного в 1-ю неделю жизни как отражение механизмов адаптации к внеутробной жизни, а потому приводим данные, полученные на кафедре педиатрии с курсами перинатологии и эндокринологии факультета усовершенствования врачей СанктПетербургской педиатрической медицинской академии.
Д.О. Иванов (1996) обследовал состояние системы гемостаза по 26 параметрам у 88 здоровых доношенных новорожденных, развивавшихся внутриутробно при неосложненном течении беременности у молодых здоровых женщин. Состояние системы гемостаза исследовали при помощи реагентов фирмы Bering. Анализировали содержание 9 прокоагулянтов; данные общекоагуляци-онных тестов: активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПТВ), тромбиновое время (ТВ); концентрации 5 ингибиторов серин-протеиназ: антитромбина III (АТ III), α1- антитрипсина (α1-АТ), протеина С (рrot. C), α2-макроглобулина (α2-МГ), С1-ингибитора (С1-ИН); уровни фибронектина (ФН), фактора Виллебранда (ФВ), высокомолекулярного кининогена (ВМК) и плазминогена (ПГ). В плазме всех детей определяли содержание продуктов деградации фибрина (ПДФ), С-реактивного белка (СРБ), орозомукоида (ОМ), α-фетопротеина (α-ФП).
Агрегацию тромбоцитов на АДФ, ристоцетин и адреналин у большинства новорожденных оценивали микроскопически (по подсчету больших, средних и малых агрегатов в фазовоконтрастном микроскопе). Кроме того, у 39 новорожденных 5 сут жизни динамику агрегации тромбоцитов на адреналин и АДФ исследовали при помощи агрегометра
(THROMLITE 1006) в течение 10 мин.
Анализ динамики функциональной активности тромбоцитов приведен в табл. 18.10, параметров коагуляционного гемостаза у здоровых детей 1-й недели жизни - в табл. 18.11, динамика ингибиторов серин-протеиназ - в табл. 18.12. В связи с тем, что часть детей не получала препараты витамина К в родильном зале, мы сочли необходимым сравнить ряд гемостазиологических параметров у двух групп детей 5-го дня жизни, отличавшихся по этому критерию. Сравнительная характеристика отдельных коагуляционных тестов, а также агрегационной активности тромбоцитов у новорожденных, получавших и не получавших Викасол♠ при рождении, дана в табл. 18.13.
Таблица 18.10. Агрегационная активность тромбоцитов (число больших агрегантов в 1
мкл, М±m)*
Показатель |
При рождении |
1-е сутки |
3-4-е сутки |
6-е сутки |
Взрослые |
|
(пуповинная кровь) |
жизни |
жизни |
жизни |
доноры |
АДФ |
29,3±3,8 |
4,7±1,8 |
8,6±3,0 |
5,7±1,1 |
48,7±3,3 |
Ристоцетин |
30,6±5,3 |
25,5±2,4 |
32,3±2,4 |
28,7±1,3 |
40,1±6,0 |
Коллаген |
1,2±0,9 |
0,0 |
0,0 |
0,0 |
25,0±4,0 |
Адреналин |
2,1±0,5 |
0,0 |
0,0 |
0,0 |
20,6±1,9 |
* По данным аспирантов нашей кафедры И.Н. Вебер и Г.Н. Чумаковой.
Анализ табл. 18.10-18.13 указывает на то, что баланс в системе гемостаза сразу после рождения поддерживается несколькими механизмами: тромбогенная
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Таблица 18.11. Параметры гемостаза у здоровых доношенных новорожденных 1-й недели жизни (М±m) (Иванов Д.О., 1996)
Показатель |
При рождении |
3-и сутки |
5-6-е сутки |
Взрослые |
|
(пуповинная |
жизни |
жизни |
доноры |
|
кровь) |
|
|
|
АЧТВ, с |
45,0±10,0 (=42,9)* |
- |
51,6±0,2 |
33,5±3,7 |
ПТВ, с |
19,0±2,1 (=13,0)* |
- |
16,8±2,5 |
12,0±1,0 |
ТВ, с |
23,1±5,7 (=23,5)* |
- |
17,2±1,2 |
17,0±2,2 |
ФГ, г/л, коагуляцион- |
2,9±0,3 |
4,7±0,2** |
2,0±0,05 |
2,9±1,4 |
ный метод иммунол. |
|
|
4,7±0,3 |
|
метод |
|
|
|
|
|
|
|
|
|
II фактор, % |
67,0±4,0 |
71,2±2,8 |
86,8±1,7*** |
- |
V фактор, % |
92,9±3,4 |
86,8±1,0 |
80,6±0,9** |
- |
VII фактор, % |
71,9±1,2 |
75,6±2,8 |
67,6±1,3 |
98,0±13,2 |
VIII фактор, % |
101,8±4,1 |
84,7±7,8** |
81,0±1,1** |
106,0±21,0 |
IX фактор, % |
- |
86,8±3,8 |
85,4±1,6 |
102,0±8,5 |
X фактор, % |
61,9±1,5 |
63,5±2,3 |
60,3±2,2 |
- |
XI фактор, % |
79,3±3,3 |
83,6±2,3 |
89,3±2,1*** |
- |
XII фактор, % |
94,8±2,4 |
96,2±8,1 |
89,1±1,1*** |
- |
ФН, % |
0,12±0,01 |
0,16±0,01 |
0,16±0,01** |
- |
ФВ, % |
160,0±35,6 |
86,0±20,8** |
121,8±15,2*** |
- |
ВМК, % |
- |
89,7±1,6 |
100,8±1,1*** |
- |
ПГ, мкг/л |
53,0±0,3 |
49,0±1,0 |
45,0±3,0 |
- |
ПДФ, мкг/л |
8,9±1,1 |
10,1±2,6 |
13,2±2,6 |
- |
СRP, % детей c ++ |
8,3 |
35,7 |
16,6** |
- |
α-ФП, мкг/л |
54,1±9,6 |
39,3±1,9** |
41,4±1,7** |
- |
ОМ, г/л |
0,19±0,03 |
0,45±0,01** |
0,42±0,0** |
- |
*Показатели венозной крови в первые сутки жизни. ** р <0,05 по сравнению с пуповинной кровью.
***р <0,05 по сравнению с данными 3-х суток (цит. по M.E. Foley и соавт.).
Таблица 18.12. Содержание физиологических ингибиторов серин-протеиназ на протяжении 1-й недели жизни у здоровых новорожденных (М±m) (Иванов Д.О., 1996)
ПоказательПри рождении - пуповинная |
3-и сутки жизни |
5-6-е сутки жизни |
|||
|
кровь (n=30) |
(n=19) |
(n=49) |
||
АТ III, г/л |
0,15±0,01 |
0,13±0,01* |
0,17±0,002** |
||
α1-АТ, г/л |
1,6±0,12 |
1,84±0,04 |
1,8±0,02 |
||
α2-МГ, г/л 3,35±0,26 |
3,0±0,005 |
3,07± 0,24 |
|||
Окончание табл. 18.12 |
|
|
|
|
|
|
|
|
|
|
|
ПоказательПри рождении - пуповинная |
|
3-и сутки жизни |
|
5-6-е сутки жизни |
|
|
кровь (n=30) |
|
(n=19) |
|
(n=49) |
|
|
|
|
|
|
Prot. С, % |
50,1±1,6 |
|
69,0±1,9* |
|
71,3±0,5* |
|
|
|
|
|
|

C1-ИН, г/л |
0,15±0,01 |
0,16±0,01 |
0,18±0,01* |
|
|
|
|
* р <0,05 по сравнению с пуповинной кровью. ** р <0,05 по сравнению c 3-ми cутками.
Таблица 18.13. Сравнительная характеристика гемостаза у здоровых детей 5 сут жизни, получавших и не получавших Викасол♠ (М±m) (Иванов Д.О., 1996)
Показатель |
Группа детей, получавших |
Группа детей, не получавших |
р |
|
Викасол♠, n=19 |
Викасол♠, n=11 |
|
АЧТВ, с |
51,6±0,20 |
77,2±3,5 |
<0,05 |
ПТВ, с |
16,8±0,25 |
24,6±1,2 |
<0,05 |
VII фактор, |
69,8±2,1 |
65,3±1,4 |
>0,05 |
% |
|
|
|
X фактор, % |
64,6±1,6 |
55,7±3,8 |
<0,05 |
Агрегация на адреналин, % |
|
|
|
2-я минута |
12,7±2,5 |
11,7±2,5 |
>0,05 |
5-я минута |
20,9±3,4 |
16,0±3,9 |
>0,05 |
8-я минута |
25,2±3,3 |
16,7±3,9 |
<0,05 |
10-я минута |
28,7±3,2 |
18,4±1,7 |
<0,05 |
Агрегация на АДФ, % |
|
|
|
2-я минута |
1,5±0,3 |
1,0±0,4 |
>0,05 |
5-я минута |
2,3±0,4 |
2,0±0,5 |
>0,05 |
8-я минута |
3,6±0,8 |
3,2±0,9 |
>0,05 |
10-я минута |
5,1±1,1 |
4,2±1,2 |
>0,05 |
Агрегация на адреналин взрослых доноров (при сравнении с детьми 5 сут жизни), %
2-я минута |
45,0±3,6 |
<0,05 |
5-я минута |
68,0±4,2 |
<0,05 |
8-я минута |
81,0±7,9 |
<0,05 |
10-я минута |
93,0 11,5 |
<0,05 |
направленность тромбоцитарного гемостаза; «уравновешивается»: низкой прокоагулянтной активностью (главным образом за счет печеночных факторов); низкой адреналин-агрегацией (ее связывают со снижением или блокадой адре-норецепторов на тромбоцитах, что при гиперкатехоламинемии препят ствует развитию тромбозов); низким содержанием плазминогена, возможно, связанным с его потреблением в ходе активного фибринолиза; низким уровнем фактора
адгезии - ФН; повышенным содержанием ПДФ (антикоагулянта и антиагреган-та). Обращает на себя внимание относительно узкий диапазон колебаний ключевого фактора каталитического каскада-X-фактора, что свидетельствует о напряженности и одновременно эффективности адаптации в коагуляционном звене.
Тромботическим осложнениям также препятствуют: транзиторная гипо-кальциемия, отмечаемая в эти же сроки; задержка воды вследствие повышенной продукции вазопрессина и альдостерона; повышенное кровоснабжение легких, стимулирующее их метаболическую активность с общей фибринолити-ческой направленностью регионарного гемостаза. По нашим данным, максимальная концентрация α2-МГ приходится именно на 1-е сутки, т. е. после расправления легких.
В последующие 2-3 сут возникают новые факторы, влияющие на гемостаз и требующие дополнительных механизмов поддержания гемореологии и транспорта кислорода. Среди них - транзиторная потеря массы тела и гипо-гидратация; окончательное функциональное закрытие боталлова протока при сохранении возможности бидиректорального шунта, что
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
