
3 курс / Патологическая физиология / Патофизиология_крови,_Фред_Дж_Шиффман
.pdf210 |
Глава 6. Гемостаз и |
тромбоз |
|
Фибринолитическая система плазмы состоит из плазминогена (профермент), плазмина (фермент), активаторов плазминогена и соответствующих ингибиторов. Активация фибринолитической системы приводит к образованию плазмина
— мощного протеолитического фермента, обладающего разнообразным действием in vivo. Предшественник плазмина — плазминоген, представляет собой гликопротеин (92 кД), продуцируемый печенью, эозинофилами и почками. Молекула плазминогена состоит из А-цепи с пятью доменами и В-цепи (каталитический домен) с N-концевой глутаминовой кислотой (Glu-плазминоген). Период полусуществования плазминогена составляет 2,2 сут. У несколько деградированной формы (Lys-плазминоген) более короткий период полусуществования (0,8 сут). Плазминоген имеет сильное сродство к лизиновым остаткам. Особенности структуры придают плазминогену способность связываться со свободными лизиновы-ми остатками фибрина; сс2-антиплазмина; гликопротеина, богатого гистидином; поверхностных рецепторов; внеклеточного матрикса; тромбоспондина и иммуноглобулинов.
Активация плазминогена. Превращение плазминогена в плазмин катализируете»
активаторами плазминогена и строго регулируется различными ингибиторами.
Последние инактивируют как плазмин, так и активаторы плазминогена (рис. 6-13 Активаторы плазминогена образуются или сосудистой стенкой (внутренш:
активация), или тканями (внешняя активация). Внутренний путь активации включает активацию белков контактной фазы: ФХП, ФХ1, ПК, ВМК и калликреина (рис. 6-4). Это важный путь активации плазминогена, но основной — чере; ткани (внешняя активация); он происходит в результате действия тканевого ак тиватора плазминогена (ТАП), выделяемого эндотелиальными клетками. ТА также продуцируется другими клетками: моноцитами, мегакариоцитами и мезс телиальными клетками.
j
ТАП представляет собой сериновую протеазу (период полусуществования I приблизительно 4 мин), которая циркулирует в крови, образуя комплекс со сво} им ингибитором, и имеет высокое сродство к фибрину. Зависимость ТАП! от фибрина ограничивает образование плазмина зоной аккумуляции фибрина,: ТАП и Glu-плазминоген связываются с фибриновыми нитями. Как только не- ] большое количество ТАП и плазминогена соединилось с фибрином, каталитическое действие ТАП на плазминоген многократно усиливается. Затем образовавшийся плазмин разлагает фибрин, обнажая новые лизиновые остатки, с которыми связывается другой активатор плазминогена (одноцепочечная уро-киназа). Плазмин превращает эту урокиназу в иную форму — активную двухце-почечную, вызывая дальнейшую трансформацию плазминогена в плазмин и растворение фибрина (рис. 6-13).
Одноцепочечная урокиназа выявляется в большом количестве в моче. Как и ТАП, она относится к сериновым протеазам. Основная функция этого фермента проявляется в тканях и заключается в разрушении внеклеточного матрикса, что способствует миграции клеток. Урокиназа продуцируется фибробластами, моноцитами/макрофагами и ЭК. Период полусуществования составляет приблизительно 7 мин. В отличие от ТАП циркулирует в не связанной с ИАП форме. Она потенцирует действие ТАП, будучи введенной после (но не до) ТАП. Как ТАП, так и урокиназа синтезируются в настоящее время методами рекомбинантной ДНК и используются в качестве лекарственных препаратов.

1ормальный гемостаз |
211 |
|
|
|
|
Другими активаторами плазминогена (нефизиологическими) являются стреп-окиназа (продуцируемая гемолитическим стрептококком), антистреплаза (ком-ллекс человеческого плазминогена и бактериальной стрептокиназы) и стафило-;иназа (продуцируемая Staphylococcus aureus). Первые два — фармакологическиеромболитические средства, применяемые для лечения острого тромбоза.
Основная функция плазмина — расщеплять фибрин и поддерживать сосуды ■! открытом состоянии. Однако плазмин разрушает многие другие субстраты, включая фибриноген, ФУ, ФУШ, ФХ, Ф1Х, ФВ и тромбоцитарные гликопротеины. Он также активирует компоненты каскада комплемента (С1, СЗа, C3d, C5). Расщепление плазмином пептидных связей в фибрине и фибриногене привоит к образованию различных дериватов с меньшей молекулярной массой,
Рис. 6-13. В верхней части рисунка представлена активация и ингибирование фибринолитическои системы. Можно видеть различные сложные взаимодействия (подробное описание и сокращения см. в тексте). В нижней части изображен процесс трансформации фибриногена в фибрин и их дегра-вции. ОЦ — одноцепочечпая; ДЦ — днухцелочечная. (Из: Beutler E., Lichtman M. A., Coller В. S., \ipps Т. J. (eds). William's Hematology, 5th ed. New York: McGraw-Hill, 1995.)

212 |
Глава 6. Гемостаз и |
|
тромбози |
а именно продуктов деградации фибрина (фибриногена) (ПДФ) или продукта расщепления фибрина (фибриногена) (ПРФ). Самый крупный дериват называется фрагментом X, который еще сохраняет аргинин-глициновые связи для дальнейшего действия, осуществляемого тромбином. Фрагмент Y (антитромбин меньше, чем X, он задерживает полимеризацию фибрина, действуя как конкурентный ингибитор тромбина. Два других, меньших по размеру фрагмента, D иЕ, ингибируют агрегацию тромбоцитов (рис. 6-14).
Плазмин в кровотоке (в жидкой фазе) быстро инактивируется естествен» образующимися ингибиторами, но плазмин в фибриновом сгустке (гелеваэ фаза) защищен от действия ингибиторов и лизирует фибрин локально. Таким образом, в физиологических условиях фибринолиз ограничен зоной фибриш-образования (гелевая фаза), то есть гемостатической пробкой. Однако при патологических состояниях фибринолиз может стать генерализованным, охватывая обе фазы плазминообразования (жидкую и гелевую), что приводит к ли-тическому состоянию (фибринолитическое состояние, активный фибринолиз). Оно характеризуется образованием избыточного количества продуктов деградации фибрина (фибриногена) в крови, а также проявляющимся клинически кровотечением.
Подобно активным сериновым протеазам системы свертывания крови, функции активаторов плазмина и плазминогена модулируются ингибиторами.
Ингибиторы плазмина: а2-антиплазмин (а2-АП), а2-макроглобулин (а2-М),а,-антитрипсин (агАТ), антитромбин III (ATIII) и ингибитор эстеразы С1 (С1-Щ.
а.2-Антиплазмин представляет собой серпин и является основным ингибитором плазмина в крови. Ему присущи 3 основных свойства: быстро ингибировать плазмин; затруднять присоединение плазминогена к фибрину; образовывать пе рекрестные связи с а-цепями фибрина во время фибринообразования. Он продуцируется печенью. При избыточном образовании плазмина в крови его нейтрализация происходит в следующей последовательности: а2-антиплазмином, а2-макроглобулином, а,-антитрипсином, AT III и Cl-И. Несмотря на присутствие различных ингибиторов, участвующих в нейтрализации плазмина in vivo, наслед-
Рис. 6-14. Действие плазмина на фибриноген, другие факторы свертывания и тромбоцить
Нормальный гемостаз |
213 |
ственный дефицит а2-антиплазмина проявляется сильным кровотечением — очевидное свидетельство недостаточности контроля активности плазмина другими ингибиторами.
а2-Макроглобулин — ингибитор плазмина (второй линии) и иных протеаз (калликреина и ТАП); действует как ингибитор-"мусорщик" (без связывания со специфическим активным центром).
Ингибиторы активатора плазминогена 1, 2, 3 (ИАП-1; ИАП-2; ИАП-3). ИАП-1
— основной ингибитор ТАП и двухцепочечной урокиназы, но он не инак-тивирует одноцепочечную урокиназу. Продуцируется ЭК, клетками гладких мышц, мегакариоцитами и мезотелиальными клетками; депонируется в тромбоцитах в неактивной форме и является серпином. Уровень ИАП-1 в крови регулируется очень точно и возрастает при многих патологических состояниях. Его продукция (и последующее ингибирование лизиса сгустка) стимулируется тромбином, трансформирующим фактором роста |3, тромбоцитарным фактором роста, интерлейкином-1, ФНО-а, инсулиноподобным фактором роста, глюкокор-тикоидами и эндотоксином. Активированный С ингибирует выделенные из ЭК ИАП и тем самым стимулирует лизис сгустка (рис. 6-11 и 6-12).
Основная функция ИАП-1 — ограничить фибринолитическую активность местом расположения гемостатической пробки за счет ингибирования ТАП. Это выполняется легко за счет большего (в молях) содержания его в сосудистой стенке по сравнению с ТАП. Таким образом, на месте повреждения активированные тромбоциты выделяют избыточное количество ИАП-1, предотвращая преждевременный лизис фибрина.
ИАП-2 — основной ингибитор двухцепочечной урокиназы.
С1-ингибитор инактивирует связанный с контактной фазой фибринолиз, в частности трансформацию одноцепочечной урокиназы в двухцепочечную.
Гликопротеин, богатый гистидином (ГБГ), является еще одним конкурент-
ным ингибитором плазминогена. Высокий уровень ИАП-1 и ГБГ в плазме обусловливает повышенную склонность к тромбозу.
Клеточная фибринолитическая система. Клеточный фибринолиз связан с лейкоцитами, макрофагами, ЭК и тромбоцитами. Он поддерживает специфическую активность как местного, так и системного фибринолиза. Лейкоциты привлекаются в зону отложения фибрина хемостатическими веществами, которые освобождают тромбоциты, образованием калликреина и продуктами деградации фибрина. Наряду с влиянием эстераз и других протеаз на разрушенный фибрин лейкоциты и макрофаги фагоцитируют фибрин и клеточные остатки, скопившиеся в месте повреждения.
Гемостатическая реакция
Реакция на повреждение сосуда зависит от разнообразных процессов взаимодействия между сосудистой стенкой, циркулирующими тромбоцитами, факторами свертывания крови, их ингибиторами и фибринолитической системой (рис. 6-15). Гемостатический процесс модифицируется посредством положительной и отрицательной обратной связи, которая поддерживает стимуляцию констрикции сосудистой стенки и образование комплексов тромбоциты-фибрин, а также растворение фибрина и релаксацию сосудов, что позволяет вернуться к нормальному состоянию.

214 |
Глава 6. Гемостаз и |
|
|
тром |
|
|
|
|
Первичное
соединение
тромбоцитов
Постоянная
гемостатическая
тромбоцитарная
пробка
Рис. 6-15. Интеграция растворимых и клеточных факторов, приводящая к образованию гемостатн ческой пробки и восстановлению сосудистой стенки (ЭТ(-эндотелин)
Нарушения гемостаза
Нарушения механизма нормального гемостаза клинически проявляются или кровотечением, или тромбозом. Кровотечение способно возникнуть из-за нарушения любого процесса, задействованного в образовании гемостатической пробки и et стабилизации. Тромбоз может быть или следствием чрезмерной активации гемо-статического механизма, или результатом нарушения его регуляции. Стадииак-
г —
Нарушения гемостаза |
215 |
тивации свертывания крови, приводящие к образованию агрегатов фибрина и тромбоцитов, одинаковы как при образовании гемостатической пробки, так и при образовании тромба. Основное различие — их локализация. Гемостатическая пробка формируется вне сосуда, а тромб — внутри него.
Нарушения, связанные с кровоточивостью Патогенез
Патологическая кровоточивость может быть обусловлена дефектом любого компонента нормального физиологического механизма гемостаза. Дефекты бывают наследственными или приобретенными и обычно классифицируются в зависимости от места действия гемостатического механизма следующим образом: дефекты сосудов, дефекты тромбоцитов (количественные и качественные), дефекты факторов свертывания крови, дефекты фибринолиза (чрезмерный фибринолиз).
Дефекты сосудов наследственного характера представляют собой структурную патологию сосудистой стенки (например, аномалия коллагена); приобретенные — являются результатом воспалительных или иммунных нарушений, поражающих кровеносные сосуды. Последние, достаточно часто встречающиеся в медицинской практике, называют также сосудистыми пурпурами.
Дефекты тромбоцитов — это изменение их количества (меньше 100 000/мкл — тромбоцитопения) или качества (тромбоцитопатия). Приобретенные нарушения тромбоцитов наблюдаются значительно чаще, чем врожденные (глава 5).
Дефекты свертывания крови могут быть наследственными или приобретенными. Последние — значительно более частое явление в клинике. Нарушения свертывания крови возникают при: 1) абсолютной недостаточности синтеза одного из факторов свертывания крови; 2) пониженном синтезе фактора (или факторов) свертывания крови; 3) образовании аномальной молекулы фактора свертывания крови; 4) чрезмерной деструкции коагуляционных факторов при патологическом состоянии активации свертывания крови (диссеминированное внутрисосудистое свертывание) с последующим быстрым клиренсом; 5) нарушении активности фактора (факторов) свертывания крови за счет приобретенных циркулирующих ингибиторов (антител).
Фибринолитические дефекты характеризуются избыточной фибринолитичес-кой активностью, которая приводит к тяжелому геморрагическому диатезу. К этим дефектам относятся: 1) наследственный дефицит Ог-антиплазмина, проявляющийся длительной тяжелой кровоточивостью вторично вследствие неконтролируемого уровня плазмина в кровообращении; 2) избыточное образование активаторов плазминогена (например, ТАП и урокиназы); 3) недостаточность инактивации активаторов плазминогена — вторичное явление, связанное с отсутствием ингибиторов или нарушением механизма их выведения (например, болезнь печени). Приобретенные нарушения встречаются значительно чаще, чем врожденные.
Клинические последствия кровоточивости
Патологическая кровоточивость иногда приводит к заболеванию и даже летальному исходу. Последний развивается редко, но соматическая патология — обычное явление и имеет различные клинические формы. Острая кровопотеря сопро-
216 |
Глава 6. Гемостаз и |
тромбоз |
|
вождается острой анемией, а та в свою очередь — гипоксией и гиповолемичесю циркуляторной недостаточностью. Хроническая кровоточивость вызывает ж\ мию вследствие возникновения дефицита железа. Массивные кровоизлияния гут сдавливать жизненно важные органы, в частности глотку, приводя к асфиксии, или головной мозг, вызывая тяжелые неврологические наруша Кровоизлияния в суставы и мышцы также связаны с опасными последствиями возникает деформация суставов, мышечные контрактуры.
Клинические данные
Анамнез. При оценке больных с патологической кровоточивостью сбор анамнез! осмотр больного и лабораторное обследование (скрининговые и специфически тесты) проводятся с учетом понимания основных механизмов нормального гемостаза. Анамнез (глава 2) должен быть направлен на определение вида кровоточивости (местная или генерализованная), тяжести и частоты ее проявления (ксщ слизистые оболочки или кровоизлияние в суставы, мышцы). Очень важно вить, возникло кровотечение спонтанно или вследствие приема лекарства, мы, удаления зубов или других видов хирургического вмешательства. Семейнш анамнез должен помочь выяснить, является ли патология наследственной, и определить вид наследования (Х-сцепленное, аутосомно-доминантное или рецессивное). Установление факта заболевания в семье имеет большое значение для пон: мания этиологии нарушения, однако отсутствие в семейном анамнезе случаев] заболевания не исключает возможности развития наследственного геморрагичес] кого диатеза. У больных с наследственной патологией нарушения обычно прояв-] ляются в детстве. Часто это — семейная кровоточивость. В социальном анамт большое значение имеет потребление алкоголя и прием лекарственных препара] тов, особенно аспирина и родственных ему соединений. При изучении медицинского анамнеза необходимо выявить заболевания, которые могли быть припиши или условием для развития кровоточивости.
Физикальное обследование. При осмотре больных (глава 2) следует обращал! внимание на вид и локализацию геморрагии (кожа, ротовая полость, глотка, глаза] суставы). Как правило, обнаруживаются следующие проявления кровоточивости, Петехии — красные пятна размером с булавочную головку. Они могут быть] рассеяны по коже и слизистым оболочкам в различных частях тела. Эти пятна об' разованы внесосудистыми эритроцитами — клетками, которые вышли из сосуда! вследствие повышенной проницаемости сосудистой стенки (сосудистая пурпура) или патологии тромбоцитов, физиологическая функция которых состоит в закрытии пробелов между ЭК. Может снижаться количество тромбоцитов либо нарушатьсяих функция. Петехии небледнеютпринажатии на них, таккаквышедшие из
сосудов эритроциты не способны проникать в сосуд вновь.
Пурпуры возникают за счет слияния петехии, причиной развития которых являются те же (указанные выше) факторы.
Экхимоз, или "синяк", представляет собой большой многоцветный плоски участок кожи с внутри- и подкожным кровоизлиянием. Экхимоз может быть результатом травмы сосуда, а также возникать у больных с нарушением функции сосудистой стенки или патологией тромбоцитов. Иногда является клини-' .ческим проявлением наследственных или приобретенных нарушений сверты вания крови.

Нарушения гемостаза ___________________________________________________ 217
Гематома — большое скопление крови, вышедшей из сосудов и инфильтрую-цей подкожные ткани и мышцы. Кожа над инфильтратом возвышается и изменяет цвет (синий). Гематома — клиническое проявление наследственного или приобретенного дефицита фактора (факторов) свертывания крови.
Гемартроз, или кровоизлияние в сустав, связан с тяжелыми дефектами факторов свертывания крови: недостаточностью фактора VIII (гемофилия А), IX (гемофилия В), в редких случаях — тяжелым дефицитом фактора XI (гемофилия С) или дефицитом факторов V, X или II.
Гематурия, или наличие крови в моче, часто наблюдается при гемофилии А и В, болезни Виллебранда и тяжелом дефиците витамина К. Причиной может бытьместноепоражениепочек.
Носовые кровотечения обычно вызваны незначительной травмой расширенных кровеносных сосудов в ноздрях, однако могут быть вторичным явлением, связанным с нарушением функции тромбоцитов или стенки сосуда либо с болезньюВиллебранда.
Телеангиэктазия и ангиомы — изменения сосудов, приводящие к появлению красных пятен или бляшек, которые исчезают принадавливании.
После изучения анамнеза и данных осмотра необходимо провести ряд обычных лабораторных тестов: пробу на обнаружение крови в кале и моче, исследование мазка периферической крови, полный клинический анализ крови, функциональные пробы печени (для исключения заболевания печени), определение азота мочевины и креатинина в крови (для исключения почечной недостаточности). После этого выполняются так называемые скрининговые тесты на кровоточивость, необходимыедляхарактеристикигеморрагического диатеза.
Лабораторноеисследование. Лабораторнаяоценканарушений, связанныхскровоточивостью, должнакасатьсякаждогокомпонентагемостатического механизма: сосудистойстенки, тромбоцитов, факторовсвертываниякрови. Лабораторные
скрининг-тестынакровоточивостьвключают:
1.Определение количества тромбоцитов (подсчет и измерение).
2.Изучение мазка периферической крови.
3.Время кровотечения (ВК), если подозревается качественное нарушение тромбоцитов или БВ.
4.Активированное частичное тромбопластиновое время (АЧТВ).
5.Протромбиновое время (ПВ).
Приприобретенныхнарушениях, напримерДВС, требуетсяпроведениедвухдополнительныхпроб:
6.Определение содержания фибриногена.
7.Определение содержания продуктовдеградациифибрина (ПДФ) илиуров ня D-димера.
1.Подсчеттромбоцитов. Определяется приисследованииобразцакровипод микроскопом. Число тромбоцитов, подсчитанное при большомувеличении в одном поле, умножается на 10 000/мкл. Более точный подсчет проводится спомощьюавтоматическогосчетчикаилиметодомфазовоконтрастноймик роскопии.
2.Изучение мазка крови дает дополнительную информацию о причине ано мального количества тромбоцитов. Так, обнаружение небольшого числа крупных тромбоцитов при наличии фрагментированных эритроцитов или
218 |
Глава 6. Гемостаз и |
|
тромбоз |
шистоцитов (глава 3) свидетельствует о повышенной деструкции тромбоцитов как причине низкого их количества и освобождения молодых больших тромбоцитов из костного мозга. Наличие миелобластов одновремеш с низким количеством малых тромбоцитов в периферической крови указывает на костномозговую инвазию лейкемическими клетками, вызывающу» уменьшение продукции тромбоцитов. Кровоточивость у больного с тем или иным дефектом тромбоцитов можа быть результатом низкого количества тромбоцитов (тромбоцитопенш) (< 100 000/мкл), нарушения функции тромбоцитов при нормальном их количестве или обусловлена качественными нарушениями этих клеток.
3.Время кровотечения (ВК) позволяет определить состояние сосудов поем взаимодействия между тромбоцитами и сосудистой стенкой. Оно измеряет ся модифицированным методом Айви. После наложения манжетки на верх нюю часть плеча и создания в ней давления 40 мм рт. ст. делается разра
на коже сгибательной поверхности предплечья (1X9 мм) с помощью одно разовой матрицы. ВК — время, необходимое для остановки кровотечения, в норме оно составляет 3-8,5 мин. ВК стандартизовано для числа тромбоци тов > 100 000/мкл. Более низкое количество тромбоцитов связано с про грессивным увеличением ВК. При первичных нарушениях сосудистой стен ки ВК отклоняется от нормы (например, при сосудистой пурпуре) такая, как при качественных нарушениях тромбоцитов и БВ.
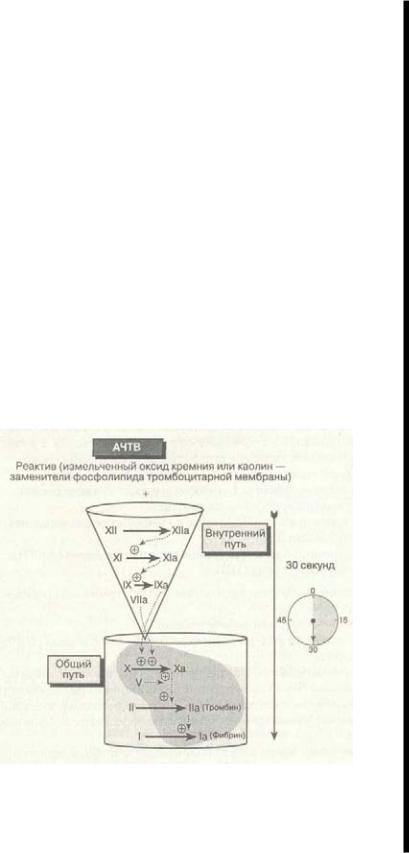
4.Активированное частичное тромбопластиновое время (АЧТВ, рис. 6-16)
Оно позволяет измерить внутренние факторы свертывания крови (факторы XII, ПК, ВМК, XI, IX, VIII) и факторы общего пути (X, V, II, I). Для прове-
Рис. 6-16. Оценка целостности внутреннего и общего пути по величине АЧТВ. Приналичии нарушенийфакторовсвертывания АЧТВ

эрушения гемостаза |
219 |
|
|
|
|
дения пробы используются активирующий агент (измельченный оксид кремния или каолин) — заменитель фосфолипидов мембраны тромбоцита, кальций и цитратная плазма больного или нормальная плазма. Последобавления активирующего агента к плазме "открывается" активный сериновый центр фактора XII, что приводит к последующей активации как факторов свертывания крови внутреннего пути, так и факторов общего пути. Активатор заменяет фосфолипид тромбоцитарной мембраны, который связывает активированные факторы IX, X, V, и II для ускорения образования сгустка в присутствии добавленного кальция. Окончание свертывания регистрируется в секундах. Величина АЧТВ в норме составляет 25-38 с.
;>и дефиците факторов свертывания крови XII, ПК, ВМК, XI, IX и VIII, а также А, V, Н и I АЧТВ возрастает.
5. Протромбиновое время (ПВ) (рис. 6-17). Этот тест позволяет оценить фактор VII (внешний путь коагуляции) и факторы X, V, II и I (факторы общего пути). В плазму пациента добавляют тканевой фактор и кальций. ТФ активирует OVII, который, в свою очередь, активирует факторы общего пути (X, V, Са2+ и фактор II), что приводит к образованию тромбина. Тромбин трансформирует фибриноген в фибрин. ПВ не учитывает состояние факторов внутреннего пути свертывания крови. Нормальный диапазонсоставляет 10-14 с.
3 можно выражать как международное нормализованное отношение (MHO), которое рассчитывается следующим образом: MHO (INR) = (ПВ больного в се-кундах/ПВ стандартной плазмы здоровых людей)мич, где МИЧ (ISI) — междуна-
Рис. 6-17. Тест на ПВ. Определяется целостность внешнего и общего пути. При нарушениитого или другого протромбиновое время
